❖본 조사 보고서의 견적의뢰 / 샘플 / 구입 / 질문 폼❖
분화 갑상선암 치료제 시장 규모 및 점유율 분석 (2025-2030)
시장 개요 및 전망
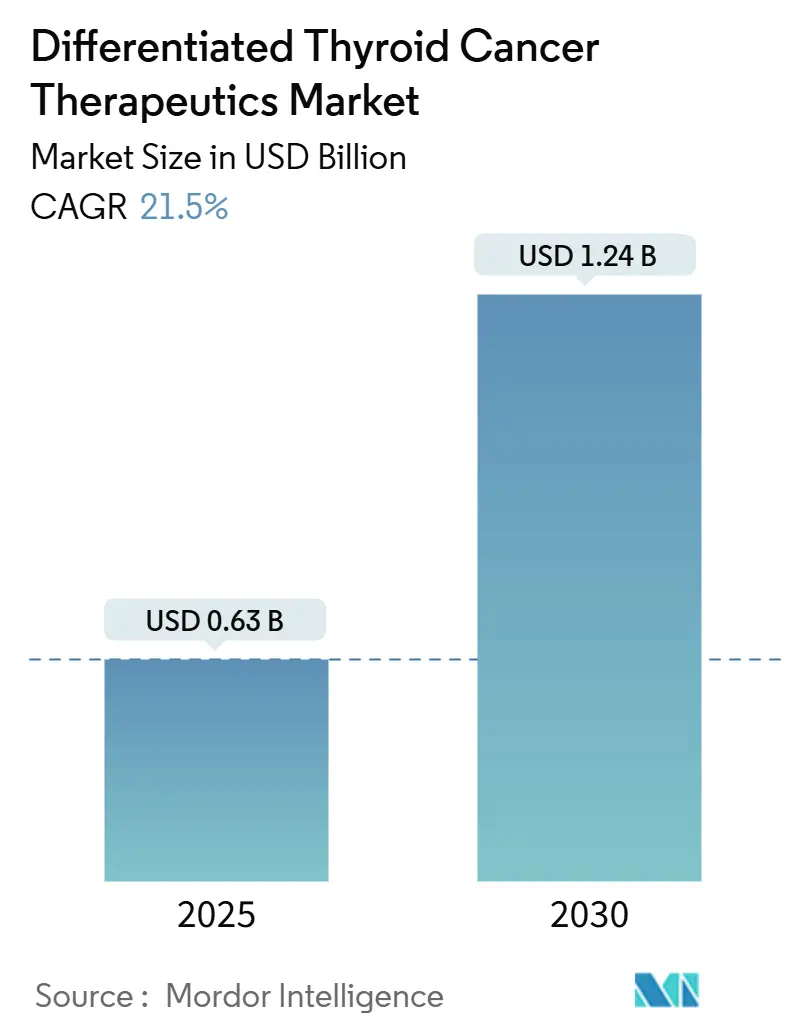
분화 갑상선암 치료제 시장은 2025년 0.63억 달러 규모에서 2030년 1.24억 달러로 성장할 것으로 예측되며, 예측 기간 동안 연평균 성장률(CAGR) 15.1%를 기록할 전망입니다. 이러한 급격한 성장은 신규 진단 사례의 꾸준한 증가와 방사성 요오드(RAI) 단독 치료를 넘어선 표적 치료제의 확산이라는 두 가지 주요 요인에 의해 주도되고 있습니다. 소아 RET 변이 갑상선암 치료제 셀퍼카티닙(selpercatinib)과 NTRK 양성 종양 치료제 레포트렉티닙(repotrectinib)과 같은 혁신적인 치료제의 승인은 시장의 혁신 속도를 보여주며 치료 가능한 환자군을 확대하고 있습니다. 주요 유전적 변이에 대한 검사가 일상화되면서 주요 시장의 보험사들은 정밀 의학 요법에 대한 상환을 확대하고 있으며, 이는 수요를 더욱 강화하고 있습니다. 동시에, 제조업체들은 새로운 방사성 의약품 생산 시설을 건설하고 동위원소 공급 계약을 체결하여 기존의 병목 현상을 완화하고 새로운 수익원을 창출하고 있습니다. 1세대 다중 키나아제 억제제(multi-kinase inhibitors)의 특허 만료가 임박함에 따라, 기업들은 독점권이 유지되는 동안 차세대 화합물 출시를 서두르고 있습니다.
주요 시장 동향 및 통찰력
1. 시장 성장 동인:
* 전 세계적 발병률 증가 및 조기 진단: 전 세계 갑상선암 발병 사례는 1990년 87,583건에서 2019년 233,847건으로 증가했으며, 특히 10~24세 연령층에서 가장 큰 폭으로 증가했습니다. 향상된 영상 기술, 인공지능(AI) 기반 병리 진단, 고소득 국가의 광범위한 선별 검사는 더 작은 크기의 종양을 발견하게 하여 더 많은 환자들이 질병 초기 단계에 분화 갑상선암 치료제 시장에 진입하도록 합니다. 조기 진단은 많은 사례가 RAI 불응성 상태로 진행되는 것을 막지만, 보조 전신 요법의 대상이 되는 절대적인 환자 수는 증가시킵니다. 한국의 국가 초음파 프로그램 지속과 전 세계적인 AI 영상 분석을 통한 미세침 흡인 검사(fine-needle aspiration) 채택 증가는 이러한 동인을 지속시킵니다.
* 승인된 표적 치료제 및 라벨 확장 확대: 2024년 미국 FDA는 셀퍼카티닙의 연령 제한을 2세로 낮췄으며, 레포트렉티닙은 치료 경험이 없는 환자에서 58%의 객관적 반응률을 보여 NTRK 양성 종양에 대한 가속 승인을 획득했습니다. 2025년 업데이트된 NCCN(National Comprehensive Cancer Network) 가이드라인은 전신 요법 전 광범위한 차세대 염기서열 분석(NGS)을 권고하며 유전체 프로파일링을 표준 진료로 확립했습니다. 이러한 복합적인 효과는 소아 및 불응성 환자군을 치료 가능한 인구로 편입시켜 분화 갑상선암 치료제 시장을 급격히 확대합니다.
* 유리한 상환 정책 및 국가 암 치료 가이드라인 포함: 미국 민간 보험사들은 NCCN Compendium을 구속력 있는 참고 자료로 활용하며, 캐나다의 시한부 권고(Time-Limited Recommendation) 경로는 2023년부터 종양학 약물의 지방 등재 기간을 단축했습니다. 실제 비용 분담 연구에 따르면, 상업 보험에 가입된 렌바티닙(lenvatinib) 사용자 중 75%가 정가 17,000달러 이상임에도 불구하고 월 100달러 이하를 지불하는 것으로 나타나, 적절한 보험 지원을 시사합니다. 펨브롤리주맙-렌바티닙(pembrolizumab-lenvatinib) 병용 요법의 가이드라인 포함은 보장 범위를 넓히고 조기 치료 시작을 장려합니다.
* 종양학 센터에서 방사성 동위원소 기반 테라노스틱스 채택 증가: 노바티스(Novartis)가 인디애나폴리스 시설에 2억 달러 이상을 투자하는 등 대형 제약사의 동위원소 제조 투자는 과거 공급 부족을 완화했습니다. 오라노 메드(Orano Med)는 2억 5천만 유로 규모의 토륨-228(thorium-228) 공장을 건설하여 납-212(lead-212) 생산량을 10배 늘려 표적 알파 치료제 생산의 길을 열고 있습니다. PET 약물에 대한 FDA의 안정성 테스트 표준은 비용을 추가하지만 품질 기대를 통일하고 병원 채택을 촉진합니다. 이러한 요인들은 정맥 주사 방사성 의약품에 대한 지속적인 수요를 뒷받침합니다.
2. 시장 성장 억제 요인:
* 특허 만료 및 제네릭 침식으로 인한 브랜드 의약품 가격 압박: 소라페닙(sorafenib)은 이미 독점권을 상실했으며, 카보잔티닙(cabozantinib)은 2031년부터 제네릭 출시가 가능해 순차적인 가격 압박이 예상됩니다. 과거 데이터에 따르면 종양학 브랜드는 제네릭 출시 후 2년 이내에 연간 매출의 52%를 잃을 수 있습니다. 혁신 기업들이 차세대 자산 출시를 서두르는 동안, 마진 축소는 분화 갑상선암 치료제 시장의 전반적인 매출 성장을 둔화시킬 수 있습니다.
* 높은 치료 비용 및 저소득 및 중간 소득 국가의 제한된 접근성: 모로코에서는 39개의 혁신적인 종양학 약물 중 22개가 상환되지 않으며, 시장 진입이 FDA 승인보다 최대 7년 지연됩니다. 남아시아 전역의 유사한 패턴은 발병률 증가에도 불구하고 치료 부족과 높은 사망률로 이어집니다. 병행 수입 프로그램과 계층별 가격 책정 계약이 가속화되지 않는 한, 신흥 시장은 질병 부담에 비해 적은 치료 단위를 기여할 것입니다.
* 다중 키나아제 억제제의 안전성 우려 및 부작용 부담: 다중 키나아제 억제제는 효과적이지만, 고혈압, 피로, 설사 등 상당한 부작용을 동반할 수 있습니다. 이러한 부작용은 환자의 삶의 질에 영향을 미치고 치료 순응도를 저해할 수 있으며, 특히 고령 환자나 동반 질환이 있는 환자에게는 치료 선택에 제약이 될 수 있습니다.
* 불안정한 전 세계 방사성 동위원소 공급망: 방사성 요오드(RAI) 치료에 필수적인 방사성 동위원소의 생산 및 공급은 소수의 원자로에 의존하고 있어, 예기치 않은 생산 중단이나 운송 문제 발생 시 공급 부족으로 이어질 수 있습니다. 이러한 불안정성은 RAI 치료의 가용성에 영향을 미쳐 환자 치료에 지연을 초래할 수 있습니다.
세그먼트 분석
1. 치료법별:
2024년 분화 갑상선암 치료제 시장은 방사성 요오드(RAI)가 34.23%의 매출 점유율로 선두를 유지했습니다. 그러나 표적 치료는 17.26%의 CAGR을 기록하며 가장 빠르게 성장할 것으로 예상되는데, 이는 적응증 확대와 환자당 지출 증가를 반영합니다. 렌바티닙과 같은 다중 키나아제 억제제는 SELECT 연구에서 위약보다 훨씬 뛰어난 18.3개월의 무진행 생존 기간 중앙값을 제공하여 의료진의 신뢰를 높였습니다. 경구용 티로신 키나아제 억제제(TKI)는 외래 진료 모델의 성장과도 일치합니다. 현재 연구 중인 면역 요법 병용은 분화 종양에서 제한적인 반응률로 인해 사용이 제한적인 화학 요법의 점유율을 가져올 수 있습니다. 유전 검사 채택은 키나아제 억제제에 대한 더 나은 결과와 관련이 있는 BRAF V600E와 같은 돌연변이를 강조하여 정밀 의학 사고방식을 강화합니다. NTRK 유전자의 내성 돌연변이는 이미 순차적 치료 선택을 형성하고 있으며, 치료 요법 설계에 계속 영향을 미칠 것입니다. 수술은 국소 질환의 1차 치료법으로 남아 있지만, 전이성 관리 및 절제 전 종양 축소를 가능하게 하는 신보조 요법 환경에서 전신 치료제가 더 큰 역할을 합니다. 새로운 알파 방출 방사성 의약품은 또 다른 고마진 범주를 제공하여 분화 갑상선암 치료제 시장을 잠재적으로 확대할 수 있습니다. 기업들은 또한 효능을 유지하면서 내약성과 순응도를 개선하는 저용량 TKI 요법을 탐색하고 있습니다. 더 많은 경구용 약물이 1차 RAI 불응성 사용에 적합해짐에 따라, 예측 기간 말까지 표적 치료제가 RAI 매출을 능가하며 치료법의 위계가 역전될 가능성이 높습니다.
2. 병기별:
국소 종양은 2024년 매출의 46.64%를 차지했는데, 이는 환자 수와 표준 수술 후 RAI 사용을 반영합니다. 그러나 전이성 또는 RAI 불응성 질환은 16.84%의 CAGR로 가장 빠르게 성장하여 고가의 표적 치료제의 대부분을 흡수할 것입니다. 최소 침습성 형태와 광범위 침습성 형태를 구분하는 새로운 WHO 분류는 위험 프로파일을 정교화하고 진행을 더 잘 예측하여 의료진이 전신 치료를 더 일찍 강화하도록 안내합니다. 미세암종에 대한 적극적 감시는 저위험 환자를 관찰 상태로 유지하여 과잉 치료율을 낮춥니다. 반대로, 국소 진행성 종양에서 신보조 BRAF/MEK 억제는 수술적 축소를 유도하여 완치 수술 후보군을 확대했습니다. 장기 생존자 데이터는 저위험군에서 20년 갑상선암 특이 사망률이 0.6%에 불과하며, 심혈관 질환이 더 큰 위협임을 보여줍니다. 이러한 수치는 선택적 개입 전략을 검증하고 진행성 질환의 적극적인 치료를 위한 자원을 확보합니다. 환자가 국소에서 전이성 단계로 진행함에 따라 처방 강도와 모니터링 빈도가 증가하여 환자 수는 적지만 불균형적인 매출 증가에 기여합니다.
3. 투여 경로별:
2024년 경구용 약물은 렌바티닙, 소라페닙 및 새로운 TKI의 인기에 힘입어 매출의 62.65%를 차지하며 시장을 지배했습니다. 정맥 주사(IV) 형태의 분화 갑상선암 치료제 시장은 방사성 리간드 치료제 출시와 면역관문억제제 병용 요법에 힘입어 15.89%의 CAGR을 기록할 것으로 예상됩니다. 근육 주사 티로트로핀 알파(thyrotropin alfa)는 여전히 틈새 진단 보조제로 남아 있으며, 연구 중인 피하 주사 옵션은 현재의 패러다임에 도전할 수 있습니다. IV 제품은 병원 또는 전문 외래 센터 인프라를 필요로 하여 중앙 약국 및 핵의학 스위트의 관련성을 강화합니다. 반대로 경구용 치료제는 외래 시설에서 조제가 가능하여 환자의 부담을 덜어줍니다. 제조업체들은 캡슐 강도를 최적화하고 1일 1회 투여 일정을 탐색하여 외래 환경으로의 처방을 더욱 유도하고 있습니다. 건설 중인 노바티스 시설을 비롯한 방사성 의약품 생산 능력의 병행 성장은 IV 부문의 모멘텀을 뒷받침할 것입니다.
4. 최종 사용자별:
병원은 수술, 핵의학 및 IV 주입을 통제하는 역할을 반영하여 2024년 매출의 43.76%를 차지했습니다. 외래 수술 센터(ASCs)는 더 많은 경구 요법과 최소 침습 시술이 병원 외부로 이동함에 따라 2030년까지 16.34%의 CAGR을 경험할 것입니다. 전문 암 센터는 유전체 검사, 임상 시험 및 다학제 종양 위원회를 제공하여 환자를 표적 또는 병용 요법으로 유도하고 고가치 치료 에피소드를 유지합니다. ASC에서 자주 수행되는 재발성 병변에 대한 고주파 절제술은 서비스 제공 장소 경제학의 변화를 보여주는 예입니다. 그럼에도 불구하고 병원은 방사성 의약품 투여, 부작용 관리 및 복잡한 목 수술에 여전히 중요한 역할을 합니다. 두 환경 모두에서 사용되는 디지털 병리 및 AI 영상은 치료의 연속성과 공동 의사 결정을 지원합니다.
5. 지역별:
북미는 포괄적인 보험 적용, 숙련된 수술 센터 및 대규모 임상 시험 네트워크에 힘입어 2024년 매출의 42.32%를 창출했습니다. 실제 데이터베이스는 렌바티닙이 미국과 캐나다에서 지배적인 1차 전신 치료제임을 보여주며, 경구용 TKI의 선점 이점을 강조합니다. 이 지역은 또한 초기 방사성 의약품 채택의 혜택을 받으며, 점점 더 많은 센터가 테라노스틱스 연구 프로그램에 참여하고 있습니다. 아시아 태평양은 한국, 일본, 중국의 발병률 증가에 힘입어 2030년까지 16.43%의 CAGR로 성장할 것입니다. 기회주의적 초음파 선별 검사는 한국에서 “유행병”으로 보고되는 데 기여했지만, 후속 연구는 여러 아시아 국가에서 단순한 진단 편향이 아닌 실제 증가가 발생하고 있음을 확인합니다. 고소득 아시아 태평양 경제는 가장 큰 장애 보정 생명년(DALY) 부담을 기록하며, 새로운 치료법이 해결할 수 있는 실질적인 미충족 의료 수요를 지적합니다. 일본과 중국에서 상환 체계가 성숙해짐에 따라 표적 약물에 대한 환자 접근성이 가속화되고 있습니다. 유럽은 통합된 EMA 프로세스와 NCCN에 부합하는 치료 경로의 광범위한 채택에 힘입어 중간 한 자릿수 성장을 유지합니다. 핵의학 인프라가 잘 구축된 독일과 프랑스에서는 방사성 동위원소 치료법의 채택률이 높습니다. 대조적으로, 중동 및 아프리카와 남미는 현재 더 작은 점유율을 차지하지만, 정부가 암 치료 시스템을 현대화하고 민간 보험사가 시장에 진입함에 따라 평균 이상의 성장을 기록하고 있습니다. 진단과 치료제를 묶는 파트너십은 이러한 지역의 자원 한계를 극복하는 데 도움이 될 수 있습니다.
경쟁 환경
분화 갑상선암 치료제 시장은 중간 정도의 통합을 보입니다. 엑셀릭시스(Exelixis), 에자이(Eisai), 바이엘(Bayer)은 광범위한 적응증을 가진 다중 키나아제 억제제를 통해 상당한 매출 풀을 공동으로 통제하고 있습니다. 이들의 임상 개발, 제조 및 시장 접근성에서의 깊이는 소규모 경쟁자들에게 강력한 진입 장벽을 만듭니다. 그러나 정밀 종양학이 유전자형 표적 약물로 전환됨에 따라, 좁은 스펙트럼의 억제제를 라이선스하거나 공동 개발하는 민첩한 바이오텍 기업들이 시장에 진입하고 있습니다.
전략적 움직임은 공급망 보안과 파이프라인 다각화에 집중됩니다. 노바티스는 방사성 의약품 생산 규모를 확대하기 위해 2억 달러 이상을 투자하여 현재 약물 및 미래 리간드의 용량 가용성을 보장하고 있습니다. 오라노 메드의 토륨-228 프로젝트는 알파 입자 치료제 원료를 다루어 파트너들에게 동위원소 부족에 대한 헤지를 제공합니다. 엑셀릭시스의 신경내분비 종양에서의 CABINET 성공은 카보잔티닙을 새로운 적응증으로 확장하는 라이프사이클 관리를 보여줍니다.
오래된 TKI에 대한 제네릭 침식은 임박했습니다. 소라페닙은 이미 독점권을 상실했으며, 카보잔티닙은 2031년에 제네릭 출시를 앞두고 있습니다. 제조업체들은 VEGF, HGF 및 AXL 키나아제를 단일 분자로 표적하는 잔잘린티닙(zanzalintinib)과 같은 차세대 억제제를 개발하여 대응하고 있습니다. M&A 활동은 활발하게 진행되고 있습니다. 일라이 릴리(Eli Lilly)의 스콜피온 테라퓨틱스(Scorpion Therapeutics) 25억 달러 인수와 GSK의 IDRx 10억 달러 인수는 초기 단계 정밀 자산에 대한 높은 가치를 강조합니다. 전반적인 경쟁 구도는 광범위한 포트폴리오를 가진 대형 제약사와 유전체 틈새 시장에 집중하는 전문 기업의 공존을 시사합니다.
주요 시장 참여 기업:
* Bayer AG
* Eisai Co Ltd
* Exelixis Inc.
* Sanofi (Genzyme)
* Curium Pharma
최근 산업 동향:
* 2025년 3월: 엑셀릭시스는 이전에 치료받은 12세 이상 진행성 신경내분비 종양 환자 치료를 위한 CABOMETYX(카보잔티닙)의 FDA 승인을 획득했습니다. 이는 원발 부위나 소마토스타틴 수용체 상태와 무관하게 승인된 최초의 전신 치료 옵션입니다.
* 2025년 2월: GSK는 10억 달러 이상을 들여 IDRx를 인수했으며, 고형암의 내성 돌연변이를 해결하도록 설계된 선택적 TKI인 IDRX-42에 접근하게 되었습니다.
* 2025년 1월: 일라이 릴리는 최대 25억 달러에 스콜피온 테라퓨틱스 인수를 발표했으며, 갑상선암 적응증으로 확장될 수 있는 정밀 종양학 후보 물질을 추가했습니다.
* 2025년 1월: 란테우스 홀딩스(Lantheus Holdings)는 에버그린 테라그노스틱스(Evergreen Theragnostics)를 2억 5천만 달러에 인수했으며, 최대 7억 5천2백5십만 달러의 마일스톤을 통해 방사성 의약품 공급을 강화했습니다.
이 보고서는 분화 갑상선암(DTC) 치료제 시장에 대한 심층 분석을 제공합니다. 연구 범위는 유두암, 여포암 및 허틀 세포암종 치료에 사용되는 처방약 및 방사성 요오드 용량에서 발생하는 제조업체 수준의 총 수익을 포함하며, 키나아제 억제제, 갑상선 호르몬 억제제, 화학요법제 및 치료용 방사성 동위원소를 다룹니다. 단, 수술, 진단 영상, 수질암 또는 역형성 갑상선암 치료는 본 연구 범위에서 제외됩니다.
연구 방법론은 북미, 유럽 및 주요 아시아 태평양 시장의 내분비학자, 핵의학 의사, 보험 약사 및 조달 관리자와의 반구조화된 인터뷰를 통한 1차 연구와 SEER, GLOBOCAN, Eurostat 암 등록 데이터, FDA 및 EMA 승인 서류, IQVIA 처방량, SEC 10-K 보고서, 동료 심사 논문 등 광범위한 2차 연구를 결합하여 신뢰성을 확보했습니다. 시장 규모 및 예측은 국가별 DTC 발생률, 치료 적격 비율 및 연평균 치료 비용을 기반으로 하는 하향식 재구성 모델을 사용하며, 유통업체 판매 데이터 및 제조업체 공개를 통한 상향식 검증을 거칩니다. RET/BRAF 검사 보급률 증가, 보조 렌바티닙(lenvatinib)을 선호하는 가이드라인 변화, 제네릭 TKI 진입, RAI 상환 상한선, 환율 변동 등 다양한 변수가 예측에 명시적으로 반영됩니다.
시장 성장을 견인하는 주요 요인으로는 전 세계적으로 분화 갑상선암의 발생률 증가 및 조기 진단, 승인된 표적 치료제의 확대 및 적응증 확장, 우호적인 보험 상환 및 국가 암 치료 가이드라인 포함, 종양학 센터에서 방사성 동위원소 기반 테라노스틱스(Theranostics) 채택 증가, 수술을 대체하는 최소 침습적 경구 투여 대안에 대한 수요 증가, 그리고 전 세계적으로 R&D 투자 및 임상 시험 파이프라인 심화 등이 있습니다.
반면, 시장 성장을 저해하는 요인으로는 특허 만료 및 빠른 제네릭 침식으로 인한 브랜드 의약품 가격 압박, 고가의 치료 비용과 저소득 및 중간 소득 국가에서의 제한된 접근성, 다중 키나아제 억제제의 안전성 문제 및 부작용 부담, 그리고 RAI(방사성 요오드) 가용성에 영향을 미치는 불안정한 글로벌 방사성 동위원소 공급망 등이 지적됩니다.
분화 갑상선암 치료제 시장은 2025년 0.63억 달러 규모에서 2030년까지 1.24억 달러에 도달할 것으로 예상되며, 연평균 성장률(CAGR)은 15.1%에 달할 전망입니다. 특히 표적 치료제 부문은 셀퍼카티닙(selpercatinib) 및 레포트렉티닙(repotrectinib)과 같은 신약 승인에 힘입어 2030년까지 17.26%의 가장 빠른 CAGR을 보이며 성장을 주도할 것입니다. 지역별로는 아시아 태평양 지역이 발생률 증가, 보험 적용 확대, 정밀 의약품 접근성 향상으로 인해 16.43%의 CAGR을 기록하며 가장 매력적인 성장 지역으로 부상하고 있습니다. 방사성 의약품은 새로운 동위원소 제조 역량과 알파 입자 치료법에 힘입어 정맥 주사 제품에서 15.89%의 CAGR을 기록하며 치료 선택지를 넓힐 것입니다. 또한, 경구용 TKI 및 최소 침습 시술이 병원에서 외래 수술 센터(ASC)로 전환됨에 따라 ASC는 16.34%의 CAGR로 성장할 것으로 예상됩니다. 소라페닙(Sorafenib) 제네릭은 이미 출시되었으며, 카보잔티닙(cabozantinib) 제네릭은 2031년부터 시장에 진입하여 브랜드 의약품 가격에 압력을 가할 것으로 보입니다.
시장은 치료법(화학요법, 표적 치료, 갑상선 자극 호르몬 억제(THS), 방사성 요오드(RAI) 치료, 기타), 병기(국소, 지역, 전이성/RAI 불응성), 투여 경로(경구, 정맥 주사, 기타), 최종 사용자(병원, 전문 암 센터, 외래 수술 센터, 기타), 그리고 지역(북미, 유럽, 아시아 태평양, 중동 및 아프리카, 남미)별로 세분화되어 분석됩니다. 경쟁 환경 분석은 시장 집중도, 시장 점유율 분석 및 Bayer AG, Eisai Co Ltd, Exelixis Inc 등 주요 기업들의 프로필을 포함합니다. 보고서는 시장 기회와 미래 전망, 특히 미개척 영역 및 충족되지 않은 요구 사항에 대한 분석을 제공하여 전략적 의사 결정에 필요한 통찰력을 제시합니다.

1. 서론
- 1.1 연구 가정 및 시장 정의
- 1.2 연구 범위
2. 연구 방법론
3. 요약
4. 시장 환경
- 4.1 시장 개요
- 4.2 시장 동인
- 4.2.1 분화 갑상선암의 전 세계적 발생률 증가 및 조기 발견
- 4.2.2 승인된 표적 치료법 및 적응증 확대
- 4.2.3 유리한 보험 적용 및 국가 암 관리 지침 포함
- 4.2.4 종양학 센터에서 방사성 동위원소 기반 테라노스틱스 채택 증가
- 4.2.5 수술에 대한 최소 침습적, 경구 투여 대안에 대한 수요 증가
- 4.2.6 전 세계적으로 심화되는 R&D 투자 및 임상 시험 파이프라인 심화
- 4.3 시장 제약
- 4.3.1 특허 만료 및 빠른 제네릭 침식으로 인한 브랜드 의약품 가격 압박
- 4.3.2 저소득 및 중간 소득 국가의 높은 치료 비용 및 제한된 접근성
- 4.3.3 멀티키나제 억제제의 안전성 문제 및 부작용 부담
- 4.3.4 RAI 가용성에 영향을 미치는 취약한 글로벌 방사성 동위원소 공급망
- 4.4 규제 환경
- 4.5 포터의 5가지 경쟁 요인
- 4.5.1 신규 진입자의 위협
- 4.5.2 구매자의 교섭력
- 4.5.3 공급자의 교섭력
- 4.5.4 대체재의 위협
- 4.5.5 경쟁 강도
5. 시장 규모 및 성장 예측 (가치, 백만 USD)
- 5.1 치료법별
- 5.1.1 화학요법
- 5.1.2 표적 치료
- 5.1.3 갑상선 자극 호르몬 억제 (THS)
- 5.1.4 방사성 요오드 (RAI) 치료
- 5.1.5 기타 치료법
- 5.2 병기별
- 5.2.1 국소
- 5.2.2 지역
- 5.2.3 전이성/RAI 불응성
- 5.3 투여 경로별
- 5.3.1 경구
- 5.3.2 정맥
- 5.3.3 기타 투여 경로
- 5.4 최종 사용자별
- 5.4.1 병원
- 5.4.2 전문 암 센터
- 5.4.3 외래 수술 센터
- 5.4.4 기타 최종 사용자
- 5.5 지역별
- 5.5.1 북미
- 5.5.1.1 미국
- 5.5.1.2 캐나다
- 5.5.1.3 멕시코
- 5.5.2 유럽
- 5.5.2.1 독일
- 5.5.2.2 영국
- 5.5.2.3 프랑스
- 5.5.2.4 이탈리아
- 5.5.2.5 스페인
- 5.5.2.6 러시아
- 5.5.2.7 유럽 기타 지역
- 5.5.3 아시아 태평양
- 5.5.3.1 중국
- 5.5.3.2 일본
- 5.5.3.3 인도
- 5.5.3.4 호주
- 5.5.3.5 대한민국
- 5.5.3.6 아시아 태평양 기타 지역
- 5.5.4 중동 & 아프리카
- 5.5.4.1 GCC
- 5.5.4.2 남아프리카
- 5.5.4.3 중동 & 아프리카 기타 지역
- 5.5.5 남미
- 5.5.5.1 브라질
- 5.5.5.2 아르헨티나
- 5.5.5.3 남미 기타 지역
6. 경쟁 환경
- 6.1 시장 집중도
- 6.2 시장 점유율 분석
- 6.3 기업 프로필 (글로벌 개요, 시장 개요, 핵심 부문, 재무, 전략 정보, 시장 순위/점유율, 제품 & 서비스, 최근 개발 포함)
- 6.3.1 Bayer AG
- 6.3.2 Eisai Co Ltd
- 6.3.3 Exelixis Inc
- 6.3.4 Sanofi (Genzyme)
- 6.3.5 Jubilant Radiopharma
- 6.3.6 Curium Pharma
- 6.3.7 Eli Lilly & Co
- 6.3.8 AstraZeneca PLC
- 6.3.9 Merck & Co Inc.
- 6.3.10 F. Hoffmann-La Roche Ltd.
- 6.3.11 Blueprint Medicines
- 6.3.12 Rosatom (JSC Isotope)
- 6.3.13 IBSA Pharma
- 6.3.14 GE HealthCare (MED radionuclides)
- 6.3.15 Siemens Healthineers (Theranostics)
- 6.3.16 Pfizer Inc
- 6.3.17 Jiangsu Hengrui Pharma
- 6.3.18 Yantai InnoPharmchem
7. 시장 기회 & 미래 전망
❖본 조사 보고서에 관한 문의는 여기로 연락주세요.❖
분화 갑상선암 치료제는 갑상선암 중 가장 흔한 형태인 유두암과 여포암을 포함하는 분화 갑상선암의 치료에 사용되는 약물들을 총칭합니다. 갑상선암은 일반적으로 예후가 좋은 암으로 알려져 있으나, 일부 환자에서는 재발하거나 다른 장기로 전이되어 생명을 위협할 수 있으며, 특히 방사성 요오드 치료에 불응하는 경우 치료가 매우 어려워집니다. 이러한 상황에서 약물 치료는 환자의 생존율을 높이고 삶의 질을 개선하는 데 필수적인 역할을 합니다.
분화 갑상선암 치료제의 종류는 크게 몇 가지로 나눌 수 있습니다. 첫째, 갑상선 호르몬 억제 요법입니다. 수술 후 갑상선 자극 호르몬(TSH) 수치를 낮게 유지하여 암세포의 성장을 억제하는 방식으로, 레보티록신과 같은 갑상선 호르몬 제제가 사용됩니다. 둘째, 방사성 요오드 치료(RAI)입니다. 갑상선 세포가 요오드를 흡수하는 특성을 이용하여 방사성 요오드를 투여함으로써 잔여 갑상선 조직이나 전이된 암세포를 파괴하는 치료법으로, 수술 후 보조 요법으로 널리 사용됩니다. 셋째, 표적 치료제입니다. 이는 암세포의 특정 성장 경로를 차단하여 암의 진행을 억제하는 약물로, 특히 방사성 요오드 불응성 진행성 분화 갑상선암 환자에게 중요한 치료 옵션입니다. 대표적으로는 혈관신생 및 세포 증식에 관여하는 여러 키나아제를 억제하는 다중 키나아제 억제제(Multi-kinase Inhibitors, MKIs)인 소라페닙과 렌바티닙 등이 있으며, 이들은 종양의 크기를 줄이고 무진행 생존 기간을 연장하는 효과를 보입니다. 또한, BRAF V600E 변이가 있는 환자에게는 BRAF 억제제(예: 다브라페닙)와 MEK 억제제(예: 트라메티닙) 병용 요법이 고려될 수 있으며, RET 유전자 융합이 있는 환자에게는 RET 억제제(예: 셀퍼카티닙, 프랄세티닙)가 사용될 수 있습니다. 넷째, 면역 항암제입니다. PD-1/PD-L1 억제제와 같은 면역관문 억제제는 아직 분화 갑상선암의 표준 치료법은 아니지만, 일부 진행성 및 불응성 환자에서 연구가 진행 중이며 제한적으로 사용될 가능성이 있습니다. 과거에는 세포독성 항암제도 사용되었으나, 표적 치료제의 등장으로 그 사용 빈도는 크게 줄어들었습니다.
이러한 치료제들은 다양한 용도로 활용됩니다. 수술 후 잔여 암세포 제거 및 재발률 감소를 위한 보조 치료(RAI, TSH 억제 요법), 재발성 또는 전이성 분화 갑상선암의 진행 억제 및 생존 기간 연장(표적 치료제), 그리고 특히 방사성 요오드 치료에 반응하지 않는 방사성 요오드 불응성 분화 갑상선암 환자의 치료에 핵심적인 역할을 합니다. 또한, 수술이 불가능한 국소 진행성 암의 경우 종양 크기 감소 및 증상 완화를 위해 사용되기도 합니다.
분화 갑상선암 치료제와 관련된 기술 발전은 매우 활발합니다. 가장 중요한 것은 분자 진단 기술의 발전입니다. BRAF, RET, RAS 등 암 관련 유전자 변이를 정확하게 검출함으로써 환자에게 가장 적합한 표적 치료제를 선택하는 정밀 의학의 기반이 됩니다. 이는 동반 진단(Companion Diagnostics)의 중요성을 증대시키고 있습니다. 또한, PET-CT, MRI, 초음파 등 첨단 영상 진단 기술은 암의 병기 설정, 전이 여부 확인, 그리고 치료 반응 평가에 필수적입니다. 최근에는 혈액을 통해 암 유전자 변이를 실시간으로 모니터링하는 액체 생검(Liquid Biopsy) 기술이 발전하여 치료 반응 예측 및 내성 발생 조기 감지에 활용될 가능성이 커지고 있습니다. 약물 전달 시스템(Drug Delivery Systems) 연구는 약물의 부작용을 최소화하고 약효를 극대화하는 방향으로 진행되고 있으며, 인공지능(AI)과 빅데이터 기술은 환자 맞춤형 치료 전략 수립과 신약 개발 가속화에 기여하고 있습니다.
분화 갑상선암 치료제 시장은 전 세계적으로 갑상선암 유병률 증가, 고령화 추세, 그리고 진단 기술의 발달로 인해 지속적인 성장세를 보이고 있습니다. 특히 방사성 요오드 불응성 분화 갑상선암 환자의 증가로 인해 표적 치료제 시장이 크게 확대되고 있습니다. 바이엘(소라페닙), 에자이(렌바티닙), 릴리(셀퍼카티닙), 로슈/GSK(다브라페닙/트라메티닙) 등 다국적 제약사들이 시장을 주도하고 있으며, 국내 제약사들도 신약 개발 및 도입에 적극적으로 참여하고 있습니다. 그러나 높은 약가, 약물 부작용 관리의 어려움, 그리고 치료 중 발생하는 내성 문제 등은 여전히 시장의 도전 과제로 남아 있으며, 미충족 의료 수요(Unmet Medical Needs)를 해결하기 위한 노력이 지속되고 있습니다.
미래 전망은 정밀 의학의 발전과 신규 치료제 개발에 초점이 맞춰져 있습니다. 유전체 분석 기반의 맞춤형 치료제 개발이 더욱 가속화될 것이며, 다양한 바이오마커 발굴을 통해 환자 개개인에게 최적화된 치료 전략을 수립하는 것이 목표입니다. 기존 표적 외에 새로운 신호 전달 경로를 억제하는 신규 표적 치료제 개발도 활발히 이루어질 것입니다. 또한, 표적 치료제 간의 병용 요법, 또는 표적 치료제와 면역 항암제, 방사성 요오드 치료와의 병용을 통해 치료 효과를 증대시키고 내성 발생을 극복하려는 연구가 중요하게 다루어질 것입니다. 분화 갑상선암에서의 면역 항암제 반응률을 높이기 위한 연구도 지속될 것이며, 환자의 삶의 질 향상을 위한 부작용 관리 및 장기 생존 환자에 대한 통합적인 관리 방안 마련 또한 중요한 과제입니다. 인공지능 기반의 진단 및 치료 예측, 원격 모니터링 등 디지털 헬스케어 기술의 접목도 미래 치료 환경을 변화시킬 주요 요소로 기대됩니다.