❖본 조사 보고서의 견적의뢰 / 샘플 / 구입 / 질문 폼❖
효소 대체 요법(Enzyme Replacement Therapy, ERT) 시장 개요 보고서 요약 (2026-2031)
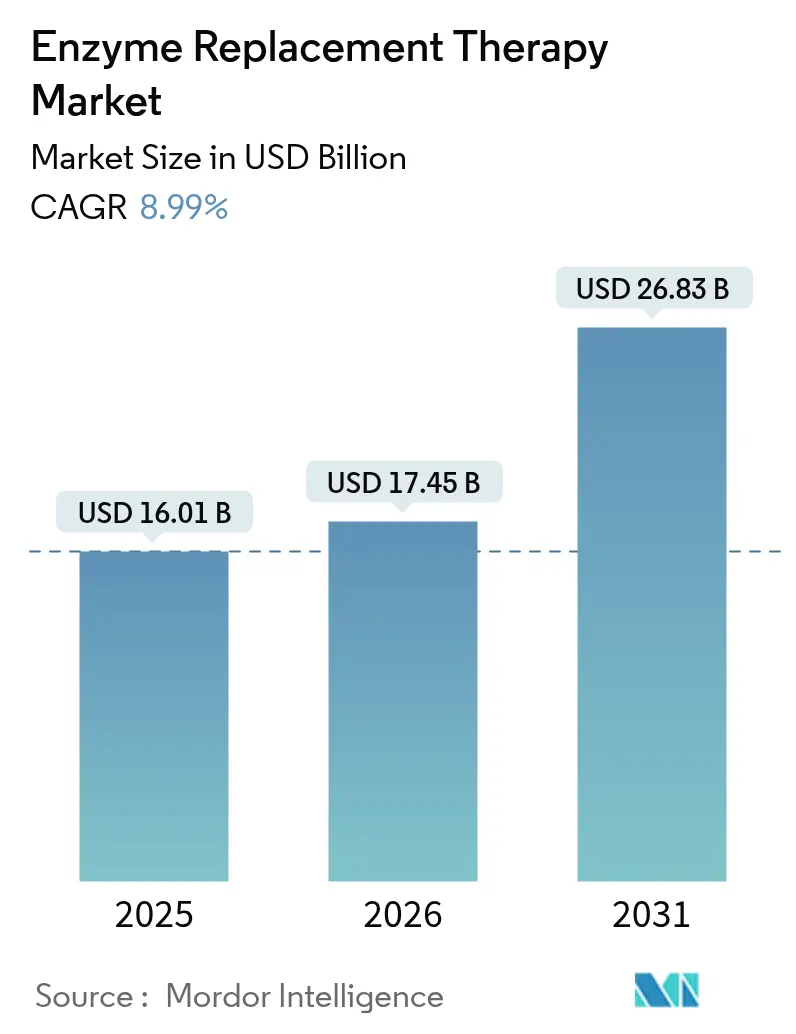
Mordor Intelligence의 보고서에 따르면, 효소 대체 요법(Enzyme Replacement Therapy, ERT) 시장은 2025년 160.1억 달러에서 2026년 174.5억 달러로 성장했으며, 2031년에는 268.3억 달러에 달할 것으로 전망됩니다. 이는 2026년부터 2031년까지 연평균 성장률(CAGR) 8.99%를 기록할 것으로 예측됩니다. 아시아 태평양 지역이 가장 빠르게 성장하는 시장으로, 북미 지역은 가장 큰 시장 점유율을 유지할 것으로 보입니다. 시장 집중도는 중간 수준으로 평가됩니다.
시장 분석 요약
ERT 시장의 지속적인 성장은 신생아 선별 검사의 확대, 진단 도구의 발전, 리소좀 축적 질환(Lysosomal Storage Disorders, LSD)에 대한 인식 증가에 기인합니다. 이러한 요인들은 현재 많은 의료 시스템에서 임상적 우선순위를 형성하고 있습니다. 또한, 기술 기반의 효소 공학 발전과 재택 주입으로의 전환은 치료 경로를 재편하고 병원 혼잡을 완화하며 환자 순응도를 높이고 있습니다. 규제 기관은 희귀 질환 치료제 승인을 가속화하고 있으며, 가치 기반 계약은 새로운 가격 책정 방식을 시험하고 있습니다. 글로벌 췌장 효소 부족 사태가 6만 명 이상의 영국 환자들에게 취약성을 노출시킨 후, 공급 탄력성은 전략적 필수 요소가 되었습니다.
주요 보고서 요점
* 효소 유형별: 이미글루세라제(Imiglucerase)가 2025년 ERT 시장 점유율 38.05%로 선두를 차지했으나, 아발글루코시다제 알파(Avalglucosidase alfa)는 2031년까지 11.12%의 CAGR로 빠르게 성장할 것으로 예상됩니다.
* 적용 분야별: 고셔병(Gaucher disease)이 2025년 ERT 시장 규모의 42.87%를 차지했으나, 폼페병(Pompe disease)은 2031년까지 11.02%의 CAGR로 확대될 것으로 전망됩니다.
* 투여 경로별: 정맥 주입(Intravenous infusions)이 2025년 매출의 91.75%를 차지했으나, 피하 주사(Subcutaneous delivery)는 10.12%의 CAGR로 성장할 것으로 예상됩니다.
* 제형별: 표준 재조합 효소(Standard recombinant enzymes)가 2025년 ERT 시장 점유율 54.60%를 기록했으며, PEG화(PEGylated) 제형은 9.85%의 CAGR로 성장할 것으로 예상됩니다.
* 최종 사용자별: 병원 및 전문 클리닉이 2025년 점유율 71.90%를 차지했으나, 재택 의료(Home healthcare)는 12.10%의 CAGR로 가장 빠르게 성장하는 채널입니다.
* 지역별: 북미가 2025년 38.10%의 점유율을 유지했으며, 아시아 태평양 지역은 2031년까지 10.08%의 가장 높은 CAGR을 기록할 것으로 전망됩니다.
글로벌 효소 대체 요법 시장 동향 및 통찰
성장 동력:
* 희귀 질환 유병률 증가 (+2.1% CAGR 영향): 중국의 신생아 유전체 프로그램에서 1,512명당 1명꼴로 리소좀 축적 질환이 확인되면서, 진단되지 않은 환자군이 상당하다는 것이 드러났고, 이는 ERT 시장의 지속적인 성장을 촉진하고 있습니다. 조기 진단은 돌이킬 수 없는 장기 손상 이전에 개입할 수 있게 하여, 후기 단계 증상 관리에 비해 평생 비용을 절감합니다. 보험사들은 조기 치료를 예방적 지출로 간주하는 경향이 커지고 있으며, 이는 희귀 질환 예산의 재조정을 가져옵니다.
* 정부 인센티브 및 자금 지원 (+1.8% CAGR 영향): 2024년 미국 FDA가 M6P Therapeutics에 6개의 희귀 소아 질환 지정을 부여한 것은 효소 후보 물질의 개발 기간을 단축시키는 규제 경로를 보여줍니다. 유럽의 희귀 유전체 치료 기금(Orphan Genomic Therapies Fund) 제안은 혁신과 공평한 접근성을 모두 지원하고자 합니다. 이러한 정책들은 바이오 제약 기업의 자본 위험을 줄이고 상업적 출시를 가속화하여 ERT 시장 내 경쟁 강도를 높입니다.
* 신생아 선별 프로그램 확대 (+1.5% CAGR 영향): UCSF의 PEARL 임상 시험은 뮤코다당증 6형(mucopolysaccharidosis type VI) 및 영아 발병 폼페병에 대한 산전 효소 치료를 시행하여, 산후 항체 형성을 잠재적으로 제거할 수 있음을 보여줍니다. 포괄적인 패널을 추가하는 국가들은 질병을 수개월 또는 수년 더 일찍 발견하여, 역사적으로 평생 장애를 유발했던 신경학적 및 골격 손상을 예방할 수 있게 합니다.
* 환자 중심 치료로의 전환 (+1.2% CAGR 영향): 이탈리아 코호트 연구에 따르면 효소 주입을 병원에서 집으로 옮길 경우 직접 비용이 25-50% 절감되며, 순응도가 높아지고 환자 스트레스가 현저히 감소합니다. COVID-19 팬데믹 동안 원격 모니터링 기술과 간호사 주도 아웃리치는 재택 투여의 안전성을 입증하여, 환자 중심 모델이 ERT 시장의 영구적인 특징으로 자리 잡게 했습니다.
* 효소 공학 기술 발전 (+1.7% CAGR 영향): 효소 공학의 기술 발전은 더 긴 반감기, 낮은 면역원성, 감소된 주입 빈도를 가능하게 하여 ERT의 효율성과 환자 편의성을 향상시킵니다.
* 혁신적인 상환 모델 (+0.8% CAGR 영향): 가치 기반 계약과 같은 혁신적인 상환 모델은 치료 비용과 임상 결과 간의 연관성을 강화하여 시장 성장을 지원합니다.
제약 요인:
* 높은 치료 비용 (−1.9% CAGR 영향): 미국에서 환자당 연간 20만~30만 달러에 달하는 높은 치료 비용은 보험사의 예산을 압박하며, 의료 지출이 적은 신흥 경제국에서의 광범위한 채택을 어렵게 합니다. 유럽의 상환율은 폴란드의 27%에서 덴마크의 88%까지 다양하여, 불균등한 접근성을 야기하고 수요를 분열시키며 수익 가시성을 저해합니다.
* 면역원성 문제 (−1.3% CAGR 영향): 효소 치료 환자의 절반은 결국 항약물 항체(anti-drug antibodies)를 생성하며, 일부는 치료 효능을 중화시키거나 주입 반응을 유발하여 치료 중단을 강요합니다. 용량 증량이나 면역 관용 유도와 같은 해결책은 비용을 증가시키고 치료를 복잡하게 만듭니다.
* 신흥 치료법과의 경쟁 (−1.1% CAGR 영향): FLT201과 같은 신흥 유전자 치료법은 바이오마커 부담을 줄일 수 있어 장기적으로 효소 대체 요법의 수요를 잠식할 수 있습니다.
* 공급망 문제 (−0.9% CAGR 영향): 글로벌 췌장 효소 부족 사태와 같은 공급망 취약성은 환자 치료의 연속성을 방해하고 시장에 부정적인 영향을 미칠 수 있습니다.
세그먼트별 분석
* 효소 유형별: 이미글루세라제는 고셔병 관리에서 확고한 역할을 해왔으나, 아발글루코시다제 알파는 폼페병 프로토콜에서 향상된 리소좀 표적화에 힘입어 빠르게 성장하고 있습니다. 차세대 제제 시장은 더 긴 반감기, 낮은 면역원성, 감소된 주입 빈도를 약속하는 PEG화 또는 당화 공학적 구조로 전환함에 따라 빠르게 확대될 것입니다.
* 적용 분야별: 고셔병 치료 프로토콜은 여러 승인된 자산과 잘 확립된 투여 알고리즘 덕분에 ERT 시장 규모의 상당 부분을 차지합니다. 폼페병은 시파글루코시다제 알파(cipaglucosidase alfa)와 미글루스타트(miglustat) 병용 요법이 단독 요법보다 우수한 성과를 보이면서 빠르게 성장하고 있습니다.
* 투여 경로별: 정맥 주입은 기존 치료 모델과 병원 인프라로 인해 2025년 매출의 대부분을 차지했습니다. 그러나 피하 주사 제형은 환자의 자율성과 짧은 진료 시간을 선호하는 경향에 힘입어 10.12%의 CAGR로 성장하고 있습니다.
* 제형별: 표준 재조합 효소는 30년간의 임상적 친숙성과 간소화된 규제 경로를 반영하여 2025년 시장 점유율의 54.60%를 차지했습니다. 그러나 PEG화 구조는 반감기를 연장하고 투여 빈도를 줄여 9.85%의 CAGR을 기록하고 있습니다.
* 최종 사용자별: 병원 및 전문 클리닉이 2025년 매출의 71.90%를 차지했으나, 재택 의료 환경은 25-50%의 명확한 비용 우위와 우수한 환자 보고 결과 덕분에 12.10%의 CAGR로 가장 빠르게 성장하고 있습니다.
지역별 분석
* 북미: 2025년 38.10%의 점유율을 유지했으며, 잘 갖춰진 보험 제도와 희귀 질환 승인을 가속화하는 FDA의 지원을 계속 받고 있습니다. 결과 기반 계약은 견인력을 얻고 있으며, 제조업체는 전문 약국 네트워크를 활용하여 당일 배송을 실행하고 순응도를 높입니다.
* 유럽: 덴마크가 비용의 88%를 상환하는 반면 폴란드는 27%만을 보장하는 등 접근성 측면에서 혼재된 양상을 보입니다. 유럽의약품청(EMA)을 통한 중앙 집중식 승인은 서류 제출을 간소화하지만, 승인 후 가격 협상은 수년이 걸릴 수 있습니다.
* 아시아 태평양: 10.08%의 CAGR로 ERT 시장에서 가장 빠르게 성장하는 지역입니다. 공격적인 신생아 선별 검사, 가계 소득 증가, 현지 생산 허브에 힘입어 성장하고 있습니다. 중국의 유전체 패널은 예상보다 높은 리소좀 질환 발생률을 밝혀냈고, 이는 1년차 치료를 보조하는 지방 정부 자금 지원 프로그램으로 이어졌습니다. 한국과 싱가포르의 위탁 제조업체들은 효소 생산 능력을 확대하고 있으며, 인도는 비용 경쟁력을 활용하여 국내 및 수출 수요를 충족하고 있습니다.
경쟁 환경
ERT 시장은 사노피(젠자임), 다케다, 바이오마린을 중심으로 중간 정도의 통합을 유지하고 있으며, 이들은 강력한 임상 경험, 특허 자산 및 글로벌 유통망을 보유하고 있습니다. 바이오마린은 2025년 1분기에 효소 자산에서 4억 8,400만 달러의 매출을 달성하며 15%의 매출 성장을 기록했습니다. 기존 기업들은 PEG화, 융합 단백질 설계 및 파이프라인 밀도를 높이는 인수를 통해 포트폴리오를 지속적으로 갱신하고 있습니다.
신규 진입자들은 잠재적으로 치료 효과가 있는 벡터 쪽으로 경쟁을 전환하고 있습니다. 스퍼 테라퓨틱스(Spur Therapeutics)의 FLT201과 리젠엑스바이오(REGENXBIO)의 RGX-121은 AAV 플랫폼을 사용하여 지속적인 효소 발현을 제공함으로써 만성 주입 수요를 잠식할 위협이 있습니다. 바이오시밀러 개발업체들은 만료되는 특허를 노리고 있지만, 높은 분석 및 면역원성 문제에 직면해 단기적으로 기존 기업들을 보호하고 있습니다. 제조 규모 또한 경쟁의 장입니다. 삼성바이오로직스는 2025년까지 78만 4천 리터의 생산 능력을 계획하고 있으며, 이는 더 빠른 처리 시간과 낮은 단위 비용을 약속합니다.
주요 시장 참여자:
* 사노피(젠자임)
* 다케다 제약(Takeda Pharmaceutical Co. Ltd)
* 바이오마린 제약(BioMarin Pharmaceutical Inc.)
* 아미쿠스 테라퓨틱스(Amicus Therapeutics)
* 울트라제닉스 제약(Ultragenyx Pharmaceutical Inc.)
최근 산업 동향
* 2025년 3월: 울트라제닉스(Ultragenyx)는 2025년 1분기 매출 1억 3,900만 달러를 보고했으며, 산필리포 증후군(Sanfilippo syndrome) 유전자 치료제 UX111은 2025년 8월 18일 PDUFA 조치일을 받았습니다.
* 2025년 3월: 사노피(Sanofi)는 혈우병 A 및 B에 대한 최초의 항트롬빈 저하 치료제인 큐피틀리아(Qfitlia, fitusiran)에 대해 FDA 승인을 획득했습니다.
* 2025년 2월: FDA는 뇌건황색종(cerebrotendinous xanthomatosis)에 대한 최초 치료제인 텍슬리(Ctexli, chenodiol)를 승인했습니다.
* 2025년 2월: 리젠엑스바이오(REGENXBIO)와 닛폰신야쿠(Nippon Shinyaku)는 RGX-121 및 RGX-111 MPS 치료제에 대한 독점 파트너십을 체결했으며, 1억 1천만 달러의 선불금과 최대 7억 달러의 마일스톤을 포함합니다.
* 2025년 1월: FDA는 POMBILITI 특허 연장에 대한 규제 검토 기간을 결정하고 2025년 12월까지 의견을 수렴할 예정입니다.
이 보고서는 효소 대체 요법(Enzyme Replacement Therapy, ERT) 시장에 대한 포괄적인 분석을 제공합니다. ERT 시장은 주로 리소좀 축적 질환 및 대사 장애와 같은 특정 생체 내 효소 결핍을 보충하기 위해 투여되는 처방 등급의 생물학적 활성 효소에서 발생하는 글로벌 수익으로 정의됩니다. 본 연구 범위에는 일반의약품 소화 효소 혼합물, 복합 제제, 그리고 전임상 단계에 있는 유전자 편집 효소 파이프라인은 제외됩니다.
주요 시장 동향 및 예측:
ERT 시장은 2026년 174억 5천만 달러에서 2031년까지 268억 3천만 달러에 이를 것으로 예상되며, 이는 상당한 성장세를 나타냅니다. 특히 고셔병(Gaucher disease) 치료 분야가 42.87%의 시장 점유율로 가장 큰 비중을 차지하고 있으며, 아시아 태평양 지역은 신생아 선별 검사 확대, 보험 적용 범위 확장, 현지 생산 역량 증대에 힘입어 10.08%의 연평균 성장률(CAGR)로 가장 빠르게 성장하는 지역으로 주목받고 있습니다.
시장 성장 동인:
시장 성장을 견인하는 주요 요인으로는 희귀 질환 유병률 증가, 정부 인센티브 및 자금 지원 확대, 신생아 선별 검사 프로그램 확장, 환자 중심 치료 모델로의 전환, 효소 공학 기술 발전, 그리고 혁신적인 상환 모델 도입 등이 있습니다.
시장 제약 요인:
반면, 높은 치료 비용, 면역원성(immunogenicity) 우려, 신흥 치료법과의 경쟁, 공급망 문제 등은 시장 성장을 저해하는 요인으로 작용하고 있습니다.
시장 세분화:
본 보고서는 시장을 다양한 기준으로 세분화하여 분석합니다.
* 효소 유형별: 이미글루세라제, 아갈시다제 알파, 아갈시다제 베타, 벨라글루세라제 알파, 탈리글루세라제 알파, 알글루코시다제 알파, 아발글루코시다제 알파, 갈설파제, 이두설파제 및 기타 효소.
* 적용 분야별: 고셔병(1, 2, 3형), 폼페병(영아 및 후기 발병), 파브리병, MPS I (헐러 증후군), MPS II (헌터 증후군), MPS IV (모르키오 증후군) 및 기타 적용 분야.
* 투여 경로별: 정맥 주입(Intravenous Infusion) 및 피하 주사(Sub-Cutaneous).
* 제형별: 표준 재조합 효소(Standard Recombinant Enzyme), PEG화/융합 단백질(PEGylated / Fusion Proteins), 유전자 활성화 차세대 효소(Gene-Activated Next-Generation Enzymes).
* 최종 사용자별: 병원 및 전문 클리닉, 재택 의료 환경, 주입 센터.
* 지역별: 북미(미국, 캐나다, 멕시코), 유럽(독일, 영국, 프랑스, 이탈리아, 스페인 등), 아시아 태평양(중국, 일본, 인도, 한국 등), 중동 및 아프리카, 남미.
경쟁 환경 및 주요 기업:
경쟁 환경 분석은 시장 집중도, 시장 점유율 분석, 그리고 Sanofi (Genzyme), Takeda Pharmaceutical Co. Ltd, BioMarin Pharmaceutical Inc., Amicus Therapeutics, Ultragenyx Pharmaceutical Inc., GC Pharma (Green Cross Corp.) 등 주요 기업들의 프로필을 포함합니다. 이 프로필은 글로벌 및 시장 수준 개요, 핵심 사업 부문, 재무, 인력, 주요 정보, 시장 순위, 시장 점유율, 제품 및 서비스, 최근 개발 분석 등을 다룹니다.
시장 기회 및 미래 전망:
미래 전망 및 기회 측면에서는, 치료 비용 상승에 대응하기 위해 지불자들이 가치 기반 계약 및 성과 기반 합의를 채택하여 상환을 측정 가능한 임상 개선과 연계하고 있습니다. 또한, 재택 주입(Home-based infusion)이 병원 환경 대비 직접 치료 비용을 25-50% 절감하고 순응도를 향상시키며 환자 치료 모델을 재편하고 있습니다. 향후 10년간 ERT 시장을 가장 크게 변화시킬 혁신으로는 FLT201 및 RGX-121과 같은 유전자 치료법이 단일 투여로 지속적인 치료 효과를 제공하여 평생 주입의 필요성을 줄일 잠재력이 있습니다.
연구 방법론:
보고서의 연구 방법론은 신뢰성을 확보하기 위해 엄격하게 설계되었습니다. 이는 임상 유전학자, 주입 센터 약사, 희귀 질환 옹호자들과의 인터뷰 및 설문 조사를 포함하는 1차 연구와, 공개된 유병률 등록부, 신생아 선별 검사 대시보드, NIH GARD, EuroDIS, 일본 NCNP 등 당국의 상환 일정을 매핑하는 2차 연구를 결합합니다. 시장 규모 산정 및 예측은 상향식 및 하향식 접근 방식을 모두 사용하여 국가 등록 데이터, 치료 흡수율, 환자당 평균 연간 비용 등을 기반으로 합니다. 데이터는 연간 업데이트되며, 새로운 FDA 승인과 같은 중대한 사건 발생 시 중간 업데이트가 이루어집니다. Mordor Intelligence는 투명한 유병률 계산, 실시간 가격 확인, 현장 인터뷰를 통해 의사 결정자들이 예산 책정, 투자 및 정책 계획에 신뢰할 수 있는 균형 잡히고 반복 가능한 기준선을 제공합니다.

1. 서론
- 1.1 연구 가정 및 시장 정의
- 1.2 연구 범위
2. 연구 방법론
3. 요약
4. 시장 환경
- 4.1 시장 개요
- 4.2 시장 동인
- 4.2.1 희귀 질환 유병률 증가
- 4.2.2 정부 인센티브 및 자금 지원
- 4.2.3 신생아 선별 검사 프로그램 확대
- 4.2.4 환자 중심 치료로의 전환
- 4.2.5 효소 공학의 기술 발전
- 4.2.6 혁신적인 상환 모델
- 4.3 시장 제약
- 4.3.1 높은 치료 비용
- 4.3.2 면역원성 문제
- 4.3.3 신흥 치료법과의 경쟁
- 4.3.4 공급망 문제
- 4.4 규제 환경
- 4.5 포터의 5가지 경쟁 요인 분석
- 4.5.1 신규 진입자의 위협
- 4.5.2 구매자의 교섭력
- 4.5.3 공급자의 교섭력
- 4.5.4 대체재의 위협
- 4.5.5 경쟁 강도
5. 시장 규모 및 성장 예측 (가치, USD)
- 5.1 효소 유형별
- 5.1.1 이미글루세라제
- 5.1.2 아갈시다제 알파
- 5.1.3 아갈시다제 베타
- 5.1.4 벨라글루세라제 알파
- 5.1.5 탈리글루세라제 알파
- 5.1.6 알글루코시다제 알파
- 5.1.7 아발글루코시다제 알파
- 5.1.8 갈설파제
- 5.1.9 이두설파제
- 5.1.10 기타 효소
- 5.2 적용 분야별
- 5.2.1 고셔병 (제1형, 제2형, 제3형)
- 5.2.2 폼페병 (영아형 & 지발형)
- 5.2.3 파브리병
- 5.2.4 MPS I (헐러 증후군)
- 5.2.5 MPS II (헌터 증후군)
- 5.2.6 MPS IV (모르키오 증후군)
- 5.2.7 기타 적용 분야
- 5.3 투여 경로별
- 5.3.1 정맥 주입
- 5.3.2 피하
- 5.4 제형별
- 5.4.1 표준 재조합 효소
- 5.4.2 PEG화 / 융합 단백질
- 5.4.3 유전자 활성화 차세대 효소
- 5.5 최종 사용자별
- 5.5.1 병원 & 전문 클리닉
- 5.5.2 가정 의료 환경
- 5.5.3 주입 센터
- 5.6 지역
- 5.6.1 북미
- 5.6.1.1 미국
- 5.6.1.2 캐나다
- 5.6.1.3 멕시코
- 5.6.2 유럽
- 5.6.2.1 독일
- 5.6.2.2 영국
- 5.6.2.3 프랑스
- 5.6.2.4 이탈리아
- 5.6.2.5 스페인
- 5.6.2.6 기타 유럽
- 5.6.3 아시아 태평양
- 5.6.3.1 중국
- 5.6.3.2 일본
- 5.6.3.3 인도
- 5.6.3.4 호주
- 5.6.3.5 대한민국
- 5.6.3.6 기타 아시아 태평양
- 5.6.4 중동 & 아프리카
- 5.6.4.1 GCC
- 5.6.4.2 남아프리카
- 5.6.4.3 기타 중동 & 아프리카
- 5.6.5 남미
- 5.6.5.1 브라질
- 5.6.5.2 아르헨티나
- 5.6.5.3 기타 남미
6. 경쟁 환경
- 6.1 시장 집중도
- 6.2 시장 점유율 분석
- 6.3 기업 프로필 (글로벌 개요, 시장 개요, 핵심 사업 부문, 재무, 직원 수, 주요 정보, 시장 순위, 시장 점유율, 제품 및 서비스, 최신 개발 분석 포함)
- 6.3.1 Sanofi (Genzyme)
- 6.3.2 Takeda Pharmaceutical Co. Ltd
- 6.3.3 BioMarin Pharmaceutical Inc.
- 6.3.4 Amicus Therapeutics
- 6.3.5 Ultragenyx Pharmaceutical Inc.
- 6.3.6 Spark Therapeutics
- 6.3.7 JCR Pharmaceuticals Co. Ltd.
- 6.3.8 Protalix Biotherapeutics
- 6.3.9 Chiesi Farmaceutici S.p.A.
- 6.3.10 GC Pharma (Green Cross Corp.)
- 6.3.11 ISU Abxis
- 6.3.12 Denali Therapeutics
- 6.3.13 CANbridge Pharmaceuticals Inc.
- 6.3.14 Pharming Group N.V.
- 6.3.15 SOBI (Orphan Biovitrum)
- 6.3.16 Avacta Group plc
- 6.3.17 Orchard Therapeutics
- 6.3.18 EUSA Pharma
- 6.3.19 Idorsia Pharmaceuticals
7. 시장 기회 및 미래 전망
❖본 조사 보고서에 관한 문의는 여기로 연락주세요.❖
효소 대체 요법은 체내에 특정 효소가 부족하거나 결핍되어 발생하는 유전성 질환, 특히 리소좀 축적 질환(LSDs)을 치료하기 위해 외부에서 해당 효소를 주입하는 의학적 치료법을 의미합니다. 이는 결핍된 효소의 기능을 보충하여 체내 유해 물질 축적을 막고 질병 진행을 늦추며 환자의 삶의 질을 개선하는 것을 목표로 합니다. 주로 정맥 주사로 투여되며, 환자는 평생 주기적으로 치료받는 경우가 많습니다. 이는 질병의 근본 원인인 효소 결핍을 직접 해결하는 접근 방식 중 하나로 평가됩니다.
효소 대체 요법의 종류는 주로 치료 대상 질환에 따라 사용 효소 종류가 달라지는 형태로 구분됩니다. 현재 대부분의 효소 대체 요법에 사용되는 효소는 재조합 DNA 기술을 통해 생명공학적으로 생산된 재조합 효소입니다. 이는 특정 유전자를 숙주 세포(예: CHO 세포)에 삽입하여 대량 생산되며, 인체 내 효소와 유사한 구조와 기능을 가집니다. 각 질환에 특화된 효소가 개발되어 사용되므로, 고셔병 치료를 위한 이미글루세라제, 파브리병 치료를 위한 아갈시다제, 폼페병 치료를 위한 알글루코시다제 등이 대표적인 예시입니다. 효소 대체 요법 자체는 아니나, 효소 결핍으로 인한 기질 축적을 줄이는 기질 감소 요법이나 효소 안정성을 높이는 샤페론 요법 등과 병용되거나 보완적인 치료법으로 함께 연구됩니다. 유전자 치료는 체내 효소 생산 능력 회복을 목표로 한다는 점에서 미래의 중요한 관련 기술로 주목받습니다.
이 요법은 주로 리소좀 축적 질환 치료에 광범위하게 활용됩니다. 대표적인 질환으로는 고셔병, 파브리병, 폼페병, 뮤코다당증(MPS)의 여러 유형(MPS I, II, IV, VI, VII 등)이 있습니다. 이 질환들은 특정 리소좀 효소 결핍으로 세포 내 불필요 물질이 축적되어 다양한 장기 손상과 신경학적 증상을 유발합니다. 효소 대체 요법은 이러한 질환들의 진행을 늦추고, 간 비장 비대, 골격 이상, 심장 기능 저하, 신경병증 등 다양한 증상을 완화하여 환자의 삶의 질을 현저히 개선합니다. 그러나 뇌혈관 장벽(Blood-Brain Barrier)을 통과하기 어렵다는 한계로 인해 중추신경계 증상에는 효과가 제한적일 수 있으며, 이 경우 뇌실 내 투여(Intrathecal administration)와 같은 특수 투여 방식이 고려되기도 합니다.
관련 기술로는 재조합 DNA 기술이 효소 대체 요법의 핵심 기반을 이룹니다. 이 기술을 통해 치료용 효소를 대량으로 안정적으로 생산합니다. 또한, 단백질 공학 기술은 효소의 안정성을 높이고, 반감기를 연장하며, 특정 세포나 조직으로의 표적 전달 효율을 개선하는 데 활용됩니다. 예를 들어, 리소좀으로의 효율적인 전달을 위해 만노스-6-인산 수용체를 이용하는 표적화 기술이 대표적입니다. 약물 전달 시스템 발전 또한 중요합니다. 리포좀과 같은 나노 운반체를 활용하여 효소의 면역원성을 줄이고 생체 내 안정성을 높이는 연구가 활발히 진행됩니다. 더불어, 질병의 조기 진단과 정확한 진단을 위한 신생아 선별 검사 및 유전자 진단 기술의 발전은 효소 대체 요법의 효과를 극대화하는 데 필수적인 요소로 작용합니다.
시장 현황을 살펴보면, 효소 대체 요법 시장은 희귀 질환 치료제 시장의 중요한 부분을 차지하며 꾸준히 성장하고 있습니다. 희귀 의약품 지정 제도를 통해 연구 개발 인센티브와 시장 독점권이 부여되어 제약사들의 투자가 활발합니다. 사노피 젠자임, 다케다, 바이오마린, 알렉시온 등 글로벌 제약사들이 주요 시장 참여자입니다. 그러나 효소 대체 요법은 개발 및 생산의 복잡성, 소수의 환자군으로 인한 높은 연구 개발 비용 등으로 인해 약가가 매우 높다는 특징을 가집니다. 이는 환자와 의료 시스템에 상당한 경제적 부담을 주며 접근성 문제를 야기합니다. 그럼에도 불구하고, 진단 기술 발전과 질병 인지도 증가, 미충족 의료 수요가 높은 희귀 질환 분야의 특성상 시장은 지속적으로 확대될 것으로 전망됩니다.
미래 전망에 있어서 효소 대체 요법은 여러 방향으로 발전할 것으로 예상됩니다. 첫째, 효소 전달 기술의 발전이 기대됩니다. 현재 정맥 주사 방식이 주를 이루지만, 특정 장기나 세포로의 표적 전달 효율을 높이는 기술, 특히 혈뇌장벽(BBB)을 통과하여 중추신경계 증상을 치료할 수 있는 기술 개발이 활발히 진행될 것입니다. 이는 치료 효과를 극대화하고 부작용을 최소화하는 데 기여할 것입니다. 둘째, 새로운 효소 및 적응증 발굴이 지속될 것입니다. 현재 치료법이 없는 다양한 희귀 효소 결핍 질환에 대한 연구가 활발해지면서, 더 많은 질환에 효소 대체 요법이 적용될 가능성이 커지고 있습니다. 셋째, 유전자 치료 및 세포 치료와의 병용 요법이 주목받을 것입니다. 효소 대체 요법이 증상을 완화하는 데 효과적이지만 근본적인 치료는 아니라는 한계를 극복하기 위해, 유전자 치료를 통해 환자 스스로 효소를 생산하게 하거나, 줄기세포 치료와 결합하여 치료 효과를 높이는 연구가 활발히 진행될 것으로 예상됩니다. 이러한 병용 요법은 장기적인 치료 효과와 환자의 삶의 질 향상에 크게 기여할 수 있습니다. 넷째, 개인 맞춤형 치료의 도입이 가속화될 것입니다. 환자 개개인의 유전적 특성, 질병 진행 양상, 약물 반응 등을 고려하여 최적의 효소 용량 및 투여 주기를 결정하는 정밀 의학적 접근이 더욱 중요해질 것입니다. 이는 치료 효과를 극대화하고 불필요한 의료비 지출을 줄이는 데 도움이 될 것입니다. 마지막으로, 생산 기술의 발전과 바이오시밀러의 등장은 약가 인하 압력으로 작용하여 효소 대체 요법의 접근성을 향상시키는 데 기여할 수 있습니다. 이는 더 많은 환자들이 치료 혜택을 받을 수 있도록 하는 중요한 요소가 될 것입니다.
결론적으로, 효소 대체 요법은 희귀 질환 치료 분야에서 중요한 위치를 차지하며 지속적인 발전을 거듭하고 있습니다. 진단 기술의 발전과 함께 전달 기술, 새로운 치료제 개발, 병용 요법, 개인 맞춤형 치료 등 다양한 방향으로 진화하며 환자들의 삶의 질을 향상시키는 데 기여할 것으로 기대됩니다. 그러나 여전히 높은 약가와 접근성 문제는 해결해야 할 과제로 남아 있으며, 이를 극복하기 위한 다각적인 노력이 필요합니다.