❖본 조사 보고서의 견적의뢰 / 샘플 / 구입 / 질문 폼❖
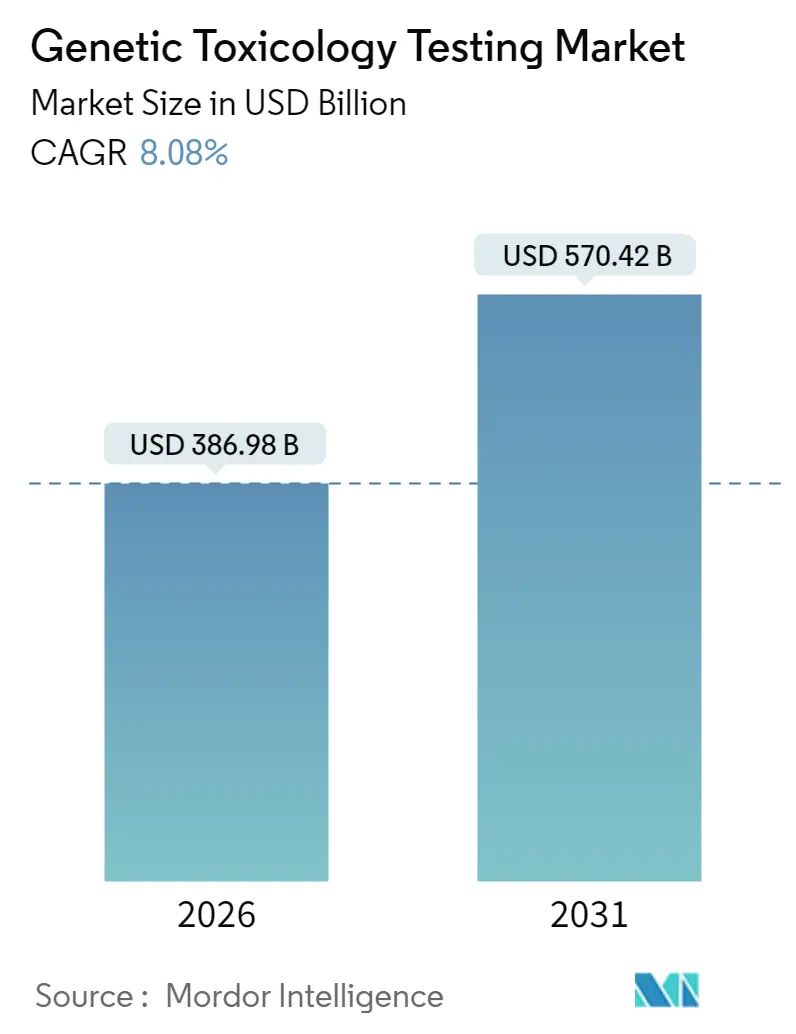
유전 독성 테스트 시장은 2025년 3억 5,805만 달러에서 2026년 3억 8,698만 달러로 성장할 것으로 예상되며, 2026년부터 2031년까지 연평균 성장률(CAGR) 8.08%를 기록하며 2031년에는 5억 7,042만 달러에 이를 것으로 전망됩니다. 이러한 견고한 성장은 세 가지 주요 요인에 의해 주도됩니다. 첫째, 전 세계 제약 R&D 지출이 2024년 2,880억 달러를 초과했으며, 특히 종양학 및 생물학적 제제 분야에서 가장 큰 예산을 차지하고 있습니다. 임상 진입 전 모든 연구 자산은 점점 더 엄격해지는 변이원성 스크리닝을 통과해야 합니다. 둘째, 미국 식품의약국(FDA) 현대화법 2.0은 신약에 대한 동물 연구 의무 조항을 삭제하여, 시험관 내(in vitro) 및 컴퓨터 시뮬레이션(in silico) 대체 방법의 즉각적인 수요를 창출했습니다. 셋째, 3D 스페로이드 배양, 장기 칩(organ-on-chip) 장치, 트랜스포머 기반 예측 모델과 같은 차세대 플랫폼은 분석 예측력을 향상시키고 연구 주기를 단축하여 업그레이드 및 신규 투자를 촉진하고 있습니다. 가장 빠르게 성장하는 시장은 아시아 태평양 지역이며, 북미가 가장 큰 시장 점유율을 차지하고 있습니다. 시장 집중도는 중간 수준입니다.
시장 성장의 주요 동력으로는 비동물 유전 독성 분석법으로의 규제 전환이 있습니다. 2024년 말 발효된 FDA 현대화법 2.0은 임상시험계획(IND) 제출 시 시험관 내 또는 컴퓨터 시뮬레이션 데이터를 공식적으로 허용하여, 설치류 연구에 대한 기본 요건을 사실상 없앴습니다. 유럽연합(EU)의 REACH 프로그램 또한 2025년 2월부터 20가지 새로운 CMR(발암성, 변이원성, 생식독성) 물질을 Annex II 및 III 화장품 목록에 추가하며 동물 실험 제한을 확대했습니다. OECD 가이드라인 섹션 4 업데이트에는 오가노이드 기반 소핵 테스트가 포함되어 국경 간 데이터 수용을 위한 조화된 경로를 구축했습니다. 이러한 움직임은 기존 제품과 파이프라인 제품 모두 현대적이고 인간 관련성이 높은 방법으로 안전성을 재검증하도록 요구함으로써 유전 독성 테스트 시장을 확장하고 있습니다.
종양학 및 생물학적 제제 파이프라인 R&D 지출 증가는 또 다른 중요한 동력입니다. 2024년 총 종양학 R&D 지출은 1,610억 달러를 초과했으며, 세포 및 유전자 기반 치료법을 추구하는 기업들이 생물학적 제제에 대한 자산당 투자를 가장 많이 늘렸습니다. 유전적 손상은 여러 메커니즘별 경로를 통해 발생할 수 있으므로, 각 양식에는 Ames, 소핵 및 γH2AX 분석법을 포함한 다층적인 테스트가 필요합니다. FDA가 승인한 myeloMATCH 정밀 의학 임상시험은 차세대 염기서열 분석과 유전 독성 종말점을 통합하여 복잡하고 다중 판독 설계에 대한 규제 기관의 관심을 보여줍니다. 이러한 지출 증가는 계약 연구 기관(CRO)의 장기적인 처리량을 보장하고 시약 및 자동화 이미징 장비에 대한 프리미엄 가격을 유지하여 유전 독성 테스트 시장의 상승 궤도를 강화합니다.
고처리량 3D 세포 배양 및 장기 칩 채택 또한 시장 성장을 견인합니다. 낮은 번역 충실도(translational fidelity)와 관련된 약물 실패는 2D 단층 배양에서 3D 스페로이드 및 미세유체 장기 칩으로의 산업 전반의 전환을 촉진했습니다. Molecular Devices의 CellXpress.ai 플랫폼은 주당 수천 개의 스페로이드에 대한 시딩, 공급 및 고함량 이미징을 자동화하여 기술자 시간을 80% 단축하고 감지 민감도를 높입니다. 신장 칩(Kidney-on-chip) 시스템은 현재 신장 독성에 대해 85%의 민감도를 달성하여 설치류 분석법을 능가하고 규제 승인을 가속화하고 있습니다. 이러한 플랫폼은 유전 독성 테스트 시장의 예상 CAGR 상승에 크게 기여하고 있습니다.
AI 기반 예측 독성학 플랫폼의 발전도 중요한 동력입니다. 트랜스포머 기반 신경망은 기존 QSAR(정량적 구조-활성 관계)로는 달성할 수 없다고 여겨졌던 정확도 장벽을 허물었습니다. 2024년 Science Advances 연구는 Tox21 데이터에서 이전 기준선 대비 AUROC(수신기 조작 특성 곡선 아래 면적)가 14포인트 증가하여 0.88에 도달했음을 기록했습니다. Merck KGaA는 Quris-AI 파일럿을 통해 간 손상 위음성을 28% 줄여 스크리닝 주기를 몇 주에서 며칠로 단축했습니다. 유럽 식품 안전청(EFSA)의 AI4NAMS 샌드박스(독성학 문서의 언어 모델 추출을 테스트)는 미래 규제 승인을 시사합니다. 이러한 발전은 컴퓨터 시뮬레이션 라이선스 및 클라우드 컴퓨팅 구독에 대한 수요를 높여 유전 독성 테스트 시장의 확장을 강화합니다.
반면, 시장 성장을 저해하는 요인도 존재합니다. 시험관 내 시스템의 제한적인 대사 활성화 충실도는 주요 제약 요인입니다. 대부분의 규제 승인 분석법은 여전히 인간의 1상 및 2상 대사를 부분적으로만 모방하는 쥐 간 S9 분획에 의존합니다. OECD 기술 시리즈 보고서는 방향족 아민의 일관성 없는 생체 활성화를 주요 위음성 원인으로 지적합니다. 미세유체 간 칩 모듈이 개선된 이종 물질 처리 능력을 보여주지만, 교차 실험실 검증은 아직 미흡하며 합의된 참조 화합물 세트도 존재하지 않습니다. 대사 능력이 표준화될 때까지 규제 기관은 여전히 확인을 위한 생체 내(in vivo) 유전 독성 종말점을 요구할 수 있으며, 이는 유전 독성 테스트 시장의 단기적인 상승 여력을 제한합니다.
실험실 간 재현성 격차 또한 시장 성장을 억제합니다. 환경 변이원 학회(Environmental Mutagen Society) 검토자들은 다양한 CRO에서 향상된 Ames 변동 테스트에 대해 최대 30%의 변동 계수(coefficient-of-variation) 수준을 보고합니다. 상이한 세포 배양 조건, 일관성 없는 시약 배치, 가변적인 이미징 알고리즘은 모두 규제 제출에 대한 신뢰를 저해합니다. MilliporeSigma와 같은 공급업체는 5가지 분석법을 단일 검증된 워크플로우로 통합하여 시간을 66% 단축하는 Aptegra™ CHO 유전 안정성 키트를 통해 이 문제를 완화하려고 시도합니다. 그럼에도 불구하고 ISO 방식의 숙련도 프로그램이 전 세계적으로 확대될 때까지 재현성 문제는 유전 독성 테스트 시장의 전반적인 성장률을 억제할 것입니다.
테스트 유형별로는 시험관 내 분석법이 2025년 매출의 64.62%를 차지하며 유전 독성 테스트 시장에서 가장 큰 비중을 차지했습니다. 세균 역돌연변이, 포유류 소핵 및 Comet 테스트는 규제 필수 요소로 남아 있으며, 꾸준한 시약 재주문 및 고함량 이미징 수요를 창출합니다. 그러나 컴퓨터 시뮬레이션 분야는 모든 방식 중 가장 빠른 8.83%의 CAGR을 기록하며 성장하고 있습니다. 이는 머신러닝 모델이 공공 ToxCast 세트에서 87.8%의 예측력을 달성했기 때문입니다. 컴퓨터 시뮬레이션 플랫폼의 유전 독성 테스트 시장 규모는 아직 미미하지만, 클라우드 컴퓨팅 및 선별된 화학 라이브러리의 확장은 초기 발견 스크리닝 전반에 걸쳐 복합적인 채택을 시사합니다. 예측 알고리즘은 점점 더 습식 실험실 우선순위를 안내하여 비생산적인 세포 기반 반복을 줄이고 확인을 위한 시험관 내 종말점에 예산을 할당합니다.
구성 요소별로는 시약 및 키트가 2025년 지출의 39.62%를 차지했으며, 소모품이 많이 사용되는 소핵 및 Comet 분석법과 간 S9 활성화 칵테일이 주를 이루었습니다. 그러나 서비스 부문은 2031년까지 9.21%의 속도로 성장하고 있으며, 이는 바이오 제약 산업의 아웃소싱 연구 모델로의 광범위한 전환을 반영합니다. Scantox Group의 Gentronix 인수는 120명 이상의 유전 독성 전문가를 추가하고 유럽 전역에 걸쳐 통합 연구실 인력을 400명 이상으로 늘렸습니다. 아웃소싱 연구를 위한 유전 독성 테스트 시장 규모는 북미 및 아시아의 우수 실험실 관리 기준(GLP) 역량 확장에 힘입어 2031년까지 2억 8,860만 달러에 이를 것으로 예상됩니다.
적용 분야별로는 제약 및 생명공학 개발업체가 2025년 매출의 47.74%를 창출하며 유전 독성 테스트 시장에서 최고 순위를 유지했습니다. 종양학 파이프라인만으로도 전체 유전 독성 작업량의 약 절반을 차지하며, 추가적인 안전 마진 데이터를 요구하는 정밀 유전자 편집 방식에 의해 촉진됩니다. 한편, EU의 동물 실험 금지 조치가 전 세계적으로 확산되고 소비자 라벨링이 “잔인함 없는(cruelty-free)” 주장으로 전환됨에 따라 화장품 및 개인관리 제품 부문에서도 유전 독성 테스트에 대한 수요가 증가하고 있습니다.
유전 독성 테스트 시장 보고서는 화학 물질, 의약품 또는 환경 물질이 유전적 손상을 유발할 수 있는 잠재력을 평가하는 유전 독성 테스트 시장에 대한 포괄적인 분석을 제공합니다. 이는 신약 개발, 환경 모니터링 및 규제 준수 분야에서 안전성 평가의 핵심 요소이며, 암, 유전성 질환 또는 기타 부작용으로 이어질 수 있는 유전 물질의 변화를 식별하는 데 중점을 둡니다.
시장 동인 및 제약:
시장은 비동물성(시험관 내 및 컴퓨터 시뮬레이션) 분석법에 대한 규제 강화, 종양학 및 생물학 파이프라인의 R&D 지출 증가, 고처리량 및 3D 세포 배양 플랫폼의 빠른 채택에 의해 주도되고 있습니다. 또한, AI 기반 예측 유전 독성 분석 및 DNA 손상 참조 물질의 표준화가 잠재적 성장 동력으로 작용합니다.
반면, 시험관 내 시스템의 제한적인 대사 활성화 충실도, 실험실 간의 가변성 및 재현성 문제, 자동화된 고처리량 스크리닝(HTS) 장비의 높은 초기 투자 비용이 시장 성장을 제약하는 요인입니다. AI 독성 모델의 지적 재산권 및 데이터 공유 장벽 또한 도전 과제로 언급됩니다.
규제 및 기술 환경:
규제 변화는 시장 수요를 크게 형성하고 있습니다. FDA 현대화법 2.0 및 EU 화장품 동물 실험 금지 조치와 같은 규제는 동물 실험을 단계적으로 폐지하고 있으며, 기업들이 검증된 시험관 내 및 컴퓨터 시뮬레이션 대안을 채택하도록 유도하고 있습니다. 기술적으로는 AI 기반 예측 분석 및 3D 세포 배양 플랫폼이 시장의 미래를 주도할 것으로 전망됩니다.
시장 규모 및 성장 예측:
유전 독성 테스트 시장은 2026년 3억 8,698만 달러에서 2031년까지 5억 7,042만 달러에 이를 것으로 전망됩니다.
테스트 유형별로는 컴퓨터 시뮬레이션(In silico) 분석법이 AI 모델의 규제 승인 증가에 힘입어 2031년까지 8.83%의 가장 높은 연평균 성장률(CAGR)을 보이며 가장 빠르게 성장하는 유형으로 부상하고 있습니다. 시장은 시험관 내(In Vitro) 테스트, 생체 내(In Vivo) 테스트, 컴퓨터 시뮬레이션(In Silico) 테스트로 세분화됩니다.
구성 요소별로는 기기 및 소프트웨어, 시약 및 소모품, 서비스(CRO)로 나뉘며, 주요 애플리케이션 분야는 제약 및 생명공학, 화학 및 농화학, 화장품 및 퍼스널 케어, 식품 및 음료 산업입니다.
지역별 분석:
지역별로는 북미, 유럽, 아시아 태평양, 남미, 중동 및 아프리카로 구분됩니다. 특히 아시아 태평양 지역은 ICH 가이드라인과의 규제 조화 및 바이오 제약 제조 역량 확장에 힘입어 2031년까지 10.05%의 CAGR로 가장 빠르게 성장하는 지역이 될 것으로 예상됩니다. 보고서는 주요 지역 내 17개국의 시장 규모 및 동향을 포함합니다.
경쟁 환경:
보고서는 시장 집중도, 시장 점유율 분석 및 Thermo Fisher Scientific, Charles River Laboratories, Eurofins Scientific, Labcorp 등 주요 20개 기업의 프로필을 포함한 경쟁 환경에 대한 심층적인 정보를 제공합니다. 각 기업 프로필에는 글로벌 및 시장 수준 개요, 핵심 부문, 재무 정보, 전략 정보, 시장 순위/점유율, 제품 및 서비스, 최근 개발 사항이 포함됩니다.
1. 서론
- 1.1 연구 가정 및 시장 정의
- 1.2 연구 범위
2. 연구 방법론
3. 요약
4. 시장 환경
- 4.1 시장 개요
- 4.2 시장 동인
- 4.2.1 비동물성(시험관 내 및 컴퓨터 시뮬레이션) 분석법에 대한 규제 강화
- 4.2.2 종양학 및 생물학적 제제 파이프라인의 R&D 지출 증가
- 4.2.3 고처리량 및 3D 세포 배양 플랫폼의 빠른 채택
- 4.2.4 AI 기반 예측 유전독성 분석 (잠재적 요인)
- 4.2.5 DNA 손상 참조 물질의 표준화 (잠재적 요인)
- 4.3 시장 제약
- 4.3.1 시험관 내 시스템의 제한적인 대사 활성화 충실도
- 4.3.2 실험실 간의 가변성 및 재현성 문제
- 4.3.3 자동화된 HTS 장비의 높은 초기 투자 비용
- 4.3.4 AI 독성학 모델에 대한 IP 및 데이터 공유 장벽 (잠재적 요인)
- 4.4 가치 / 공급망 분석
- 4.5 규제 환경
- 4.6 기술 전망
- 4.7 포터의 5가지 경쟁 요인
- 4.7.1 구매자 교섭력
- 4.7.2 공급자 교섭력
- 4.7.3 신규 진입자의 위협
- 4.7.4 대체재의 위협
- 4.7.5 경쟁 강도
5. 시장 규모 및 성장 예측 (가치)
- 5.1 테스트 유형별
- 5.1.1 시험관 내(In Vitro) 테스트
- 5.1.2 생체 내(In Vivo) 테스트
- 5.1.3 컴퓨터 시뮬레이션(In Silico) / 전산 테스트
- 5.2 구성 요소별
- 5.2.1 기기 및 소프트웨어
- 5.2.2 시약 및 소모품
- 5.2.3 서비스 (CRO)
- 5.3 적용 분야별
- 5.3.1 제약 및 바이오테크
- 5.3.2 화학 및 농화학
- 5.3.3 화장품 및 퍼스널 케어
- 5.3.4 식품 및 음료
- 5.4 지역별
- 5.4.1 북미
- 5.4.1.1 미국
- 5.4.1.2 캐나다
- 5.4.1.3 멕시코
- 5.4.2 유럽
- 5.4.2.1 독일
- 5.4.2.2 영국
- 5.4.2.3 프랑스
- 5.4.2.4 이탈리아
- 5.4.2.5 스페인
- 5.4.2.6 기타 유럽
- 5.4.3 아시아 태평양
- 5.4.3.1 중국
- 5.4.3.2 인도
- 5.4.3.3 일본
- 5.4.3.4 대한민국
- 5.4.3.5 호주
- 5.4.3.6 기타 아시아 태평양
- 5.4.4 남미
- 5.4.4.1 브라질
- 5.4.4.2 아르헨티나
- 5.4.4.3 기타 남미
- 5.4.5 중동 및 아프리카
- 5.4.5.1 GCC
- 5.4.5.2 남아프리카 공화국
- 5.4.5.3 기타 중동 및 아프리카
6. 경쟁 환경
- 6.1 시장 집중도
- 6.2 시장 점유율 분석
- 6.3 기업 프로필 (글로벌 개요, 시장 개요, 핵심 부문, 재무 정보(가능한 경우), 전략 정보, 주요 기업의 시장 순위/점유율, 제품 및 서비스, 최근 개발 포함)
- 6.3.1 써모 피셔 사이언티픽
- 6.3.2 찰스 리버 래버러토리스
- 6.3.3 유로핀스 사이언티픽
- 6.3.4 랩코프 (코반스)
- 6.3.5 젠트로닉스 / 스캔톡스 그룹
- 6.3.6 SGS
- 6.3.7 에보텍 (사이프로텍스)
- 6.3.8 머크 KGaA
- 6.3.9 애질런트 테크놀로지스
- 6.3.10 바이오-래드 래버러토리스
- 6.3.11 다나허 (통합 DNA 기술)
- 6.3.12 IQVIA
- 6.3.13 톡시콘
- 6.3.14 유로핀스 애드비너스
- 6.3.15 SGS 바이트롤로지
- 6.3.16 엔비고
- 6.3.17 찰스 리버 — 병리학 협회
- 6.3.18 신진 인터내셔널
- 6.3.19 우시 앱텍
- 6.3.20 코반스 유전 독성학

유전 독성 시험은 화학 물질이나 물리적 요인이 생체 내 유전 물질인 DNA에 손상을 주어 돌연변이, 염색체 이상, 암 발생 등 유전적 변화를 유발할 수 있는 잠재적 위험성을 평가하는 중요한 안전성 시험입니다. 이는 인체 건강 및 환경 안전성 평가에 필수적인 과정으로, 물질이 DNA에 직접적인 손상을 주거나 DNA 복제 및 분열 과정에 영향을 미 미치는지 여부를 확인합니다.
유전 독성 시험의 종류는 크게 세 가지 범주로 나눌 수 있습니다. 첫째, 유전자 돌연변이 시험은 특정 유전자의 염기 서열 변화를 검출하는 시험으로, 대표적으로 세균 복귀 돌연변이 시험인 에임즈 테스트(Ames test)가 널리 사용됩니다. 이는 미생물을 이용하여 물질의 돌연변이 유발 가능성을 신속하게 평가합니다. 포유류 세포를 이용한 유전자 돌연변이 시험도 중요한 방법 중 하나입니다. 둘째, 염색체 이상 시험은 세포 내 염색체의 구조적 또는 수적 이상을 검출하는 시험입니다. 체외 염색체 이상 시험은 배양된 포유류 세포에서 염색체 파손이나 재배열 등을 관찰하며, 생체 내 소핵 시험은 설치류의 골수 세포나 말초 혈액 적혈구에서 소핵(micronucleus)의 형성 여부를 통해 염색체 손상을 평가합니다. 셋째, DNA 손상 및 복구 시험은 DNA의 직접적인 손상 여부와 손상된 DNA를 복구하는 능력을 평가합니다. 코멧 분석(Comet assay)은 단일 세포 수준에서 DNA 가닥 절단 등을 직접 측정하는 방법이며, 비계획적 DNA 합성(Unscheduled DNA Synthesis, UDS) 시험은 DNA 손상 후 복구 과정을 평가합니다.
이러한 유전 독성 시험은 다양한 분야에서 광범위하게 활용됩니다. 의약품 개발 과정에서는 신약 후보 물질의 전임상 단계에서 안전성을 평가하는 데 필수적이며, 화학 물질 안전성 평가에서는 농약, 산업 화학 물질, 화장품 원료, 식품 첨가물 등의 규제 승인 및 안전 관리에 중요한 역할을 합니다. 또한, 환경 오염 물질 모니터링을 통해 수질, 토양, 대기 중 유해 물질의 유전 독성 가능성을 평가하고, 의료기기 및 생체 재료의 인체 적합성 평가에도 적용됩니다. 국내외 규제 기관인 OECD, ICH, 식품의약품안전처 등의 가이드라인을 준수하기 위한 필수적인 시험 항목이기도 합니다.
유전 독성 시험과 관련된 기술은 지속적으로 발전하고 있습니다. 고처리량 스크리닝(High-Throughput Screening, HTS) 기술은 대량의 물질을 신속하게 평가하여 초기 단계에서 유전 독성 가능성이 있는 물질을 효율적으로 선별하는 데 기여합니다. 유전체학, 전사체학, 단백질체학 등 오믹스(Omics) 기술은 유전 독성 반응과 관련된 유전자 발현 변화나 단백질 변화를 전반적으로 분석하여 메커니즘을 심층적으로 이해하는 데 활용됩니다. 또한, 동물 복지 및 비용 절감을 위한 대체 시험법 개발이 활발하며, 3D 세포 배양 모델이나 오가노이드(organoid)와 같은 비동물 시험법이 주목받고 있습니다. 최근에는 인공지능(AI) 및 머신러닝 기술을 활용하여 기존 데이터를 기반으로 유전 독성을 예측하고, 시험 결과 분석 및 해석의 효율성을 높이는 연구도 활발히 진행되고 있습니다.
시장 배경을 살펴보면, 전 세계적으로 화학 물질 및 의약품 안전성 규제가 강화되면서 유전 독성 시험 시장은 꾸준히 성장하고 있습니다. 제약 및 화학 기업들은 전문적인 계약 연구 기관(CRO, Contract Research Organization)에 유전 독성 시험을 위탁하는 경향이 증가하고 있으며, 이는 시장 성장의 주요 동력 중 하나입니다. 새로운 시험법과 자동화 기술의 도입은 시장의 효율성과 정확성을 향상시키고 있으며, 환경 및 건강에 대한 소비자 및 정부의 인식이 높아지면서 안전성 평가의 중요성이 더욱 부각되고 있습니다. 특히, 아시아 태평양 지역은 제약 및 화학 산업의 성장에 힘입어 유전 독성 시험 시장이 빠르게 성장하는 주요 지역으로 부상하고 있습니다.
미래 전망에 있어서 유전 독성 시험은 여러 방향으로 발전할 것으로 예상됩니다. 단일 시험 결과보다는 여러 시험법의 결과를 통합하여 종합적으로 유전 독성을 평가하는 통합적 접근 방식(Integrated Approaches to Testing and Assessment, IATA)이 더욱 중요해질 것입니다. 동물 복지 및 윤리적 문제, 그리고 비용 효율성 때문에 3R 원칙(Replacement, Reduction, Refinement)에 기반한 비동물 시험법의 개발 및 적용이 더욱 활발해질 것입니다. 인공지능과 머신러닝을 활용한 QSAR(Quantitative Structure-Activity Relationship) 모델 및 독성 예측 모델은 더욱 정교해져 시험 시간과 비용을 절감하는 데 기여할 것입니다. 또한, 유전체, 전사체, 단백질체 등 다중 오믹스 데이터를 통합 분석하여 유전 독성 메커니즘을 심층적으로 이해하고, 바이오마커를 발굴하는 연구가 활발해질 것입니다. 개인의 유전적 특성을 고려한 맞춤형 독성 평가 기술이 발전하여 정밀 의학 분야에 기여할 가능성도 있으며, 시험 과정의 자동화 및 표준화가 더욱 진전되어 시험 결과의 신뢰성과 재현성을 높이는 방향으로 나아갈 것입니다.