❖본 조사 보고서의 견적의뢰 / 샘플 / 구입 / 질문 폼❖
면역사이토카인 시장 규모 및 점유율 분석 – 성장, 동향 및 예측 (2025-2030)
시장 개요
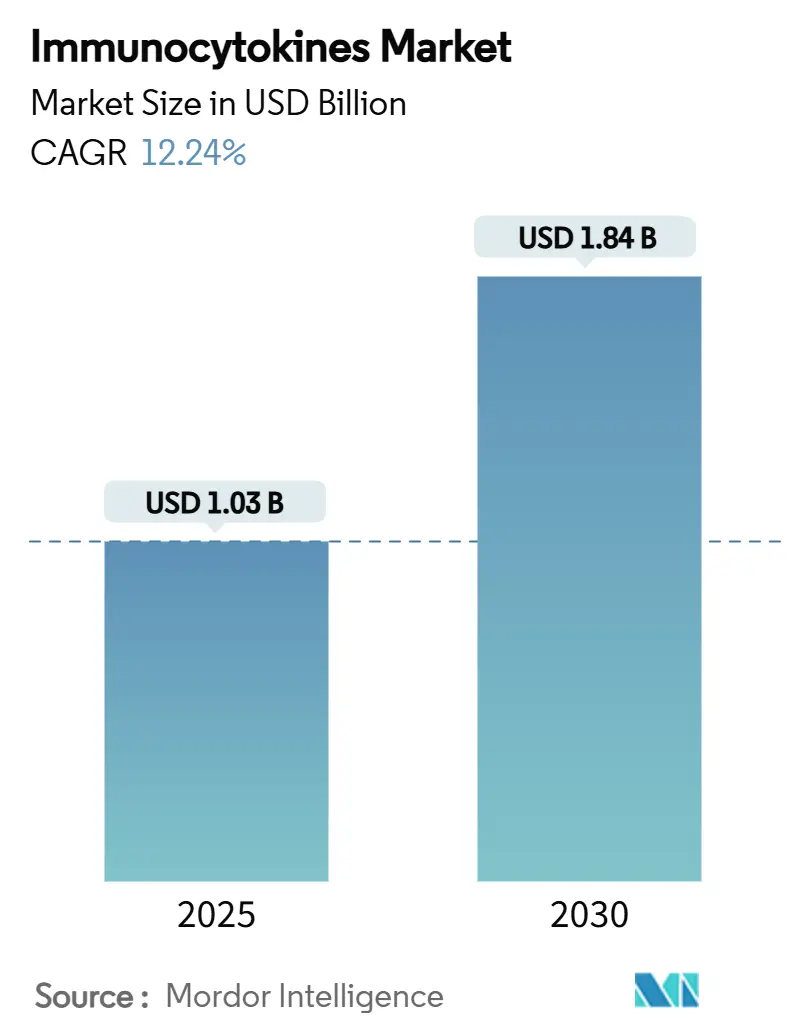
면역사이토카인(Immunocytokines) 시장은 2025년 10억 3천만 달러 규모에서 2030년까지 연평균 12.24%의 견고한 성장률(CAGR)을 기록하며 18억 4천만 달러에 이를 것으로 전망됩니다. 이러한 성장은 IL-2 및 IL-15 기반 융합 치료제의 강력한 임상적 증거, FDA 혁신 치료제(Breakthrough) 및 희귀의약품(Orphan) 지정과 같은 지속적인 규제 인센티브, 대형 제약 파트너로부터의 자본 유입에 힘입은 바가 큽니다. 또한, AI 기반 제어와 연속 생물공정을 결합한 제조 플랫폼 업그레이드는 제조원가(COGS)를 최대 30%까지 절감하여 소규모 신규 기업의 빠른 성장을 촉진하고 있습니다. 면역관문억제제와 면역사이토카인을 결합한 시너지 요법은 난치성 종양 환자의 생존율을 개선하고 적격 환자군을 확대하고 있으며, 차세대 유전자 및 벡터 인코딩 방식은 지속적인 생체 내 사이토카인 발현을 가능하게 할 것으로 기대됩니다.
지역적으로는 북미가 심층적인 임상 시험 인프라와 관대한 희귀의약품 세금 공제를 통해 선점 우위를 유지하고 있습니다. 그러나 아시아 태평양 지역은 호주, 일본, 중국 등에서 규제 승인이 가속화되면서 가장 빠른 증분 성장을 보이고 있습니다. 학술 스핀오프 기업들이 기초 연구 성과를 임상 프로그램으로 전환하면서 혁신 속도와 틈새 적응증에 집중하며 경쟁 강도가 심화되고 있습니다.
주요 시장 통계 (2025-2030)
* 연구 기간: 2019 – 2030년
* 2025년 시장 규모: 10억 3천만 달러
* 2030년 시장 규모: 18억 4천만 달러
* 성장률 (2025-2030): 12.24% CAGR
* 가장 빠르게 성장하는 시장: 아시아 태평양
* 가장 큰 시장: 북미
* 시장 집중도: 중간
* 주요 기업: 필로젠(Philogen S.p.A.), 넥타 테라퓨틱스(Nektar Therapeutics), 이뮤니티바이오(ImmunityBio Inc.), F. 호프만-라 로슈(F. Hoffmann-La Roche AG), 실리오 테라퓨틱스(Xilio Therapeutics)
주요 시장 동인 및 제약 요인
시장 동인:
1. IL-2 융합 치료제의 임상적 성공: BCG-불응성 방광암 치료제 안크티바(ANKTIVA)의 5년간 지속적인 반응 데이터는 IL-2 설계 원리를 입증했으며, 비소세포폐암에서의 PD-1 억제제와의 병용 요법에서도 유망한 결과를 보여주고 있습니다. NK 및 CD8 T 세포의 선택적 증식과 조절 T 세포(Treg) 확장 억제는 양호한 안전성 프로파일을 제공하며, FDA의 췌장암 RMAT 지정은 개발 일정을 단축하고 자본 위험을 낮추고 있습니다.
2. 면역사이토카인 + 면역관문억제제 병용 요법 채택 증가: 이 병용 요법은 지친 림프구를 재활성화하고 항원 노출을 확대하여 종양 회피를 해결합니다. QUILT 3.055 연구에서 2차 폐암 환자의 생존율 개선이 보고되었으며, PD-L1 상태와 무관하게 지속적인 활성을 보여 개발사들이 단일 요법에서 병용 요법 중심으로 파이프라인 우선순위를 전환하도록 장려하고 있습니다.
3. 제조 플랫폼 발전으로 인한 COGS 감소: 자동 관류 생물반응기(perfusion bioreactors)와 인라인 분석(inline analytics)은 배치 실패율을 40% 줄이고 제조원가를 약 30% 절감했습니다. AI 기반 예측 제어는 복잡한 다중 도메인 융합 단백질의 수율 재현성을 최적화하며, 일회용 조립체(single-use assemblies)는 빠른 생산 라인 전환을 가능하게 합니다.
4. 자가면역 질환으로의 파이프라인 확장: 사노피(Sanofi)와 신테카인(Synthekine)의 IL-10 면역사이토카인 개발 협력은 정밀 사이토카인 조절이 광범위한 면역억제제를 대체할 수 있다는 대형 제약사의 확신을 보여줍니다. 종양학 안전성 데이터의 재활용은 자가면역 질환 임상 일정을 단축하며, 난치성 자가면역 질환의 유병률 증가는 면역사이토카인 시장의 새로운 성장 동력이 되고 있습니다.
5. 희귀 종양에 대한 희귀의약품 인센티브: 미국 및 EU 지역에서 희귀 종양에 대한 희귀의약품 인센티브는 자본 위험을 줄이고 개발을 촉진합니다.
시장 제약 요인:
1. 사이토카인 방출 증후군 및 관련 안전성 문제: 면역 활성화 증가는 3등급 이상의 부작용 위험을 수반하며, 면밀한 모니터링이 필요합니다. 안크티바(ANKTIVA)의 용량 증량 코호트에서 요로 자극 및 일시적인 크레아티닌 상승이 관찰되었으며, 고용량에서는 독성 한계에 근접했습니다.
2. 높은 GMP 스케일업 및 QA/QC 비용: 다중 도메인 융합 사이토카인의 상업적 제조에는 전용 시설, 바이러스 제거 검증 및 고급 분석이 필요하며, 총 시설 투자 비용이 5천만 달러를 초과할 수 있어 소규모 개발사에게는 부담이 됩니다.
3. 불충분한 바이오마커 기반 환자 계층화: 효과적인 치료를 위한 환자 선별에 필요한 바이오마커의 부족은 장기적인 과제로 남아있습니다.
4. 이중특이성 항체 및 세포 치료 양식의 경쟁 압력: 이중특이성 항체 및 세포 치료제와 같은 대체 치료법의 발전은 면역사이토카인 시장에 경쟁 압력을 가하고 있습니다.
세그먼트 분석
사이토카인 유형별:
IL-2 융합 구조체는 2024년 면역사이토카인 시장 점유율의 39.24%를 차지하며 상업적 선두를 유지하고 있습니다. 그러나 IL-12 구조체는 2030년까지 16.32%의 CAGR로 가장 역동적인 성장을 보일 것으로 예상됩니다. XTX301과 같은 종양 활성화 형태의 IL-12는 종양 미세환경 내에서 효소적으로 활성화될 때까지 비활성 상태를 유지하여 건강한 조직을 보호하면서 강력한 선천성 및 적응성 면역을 유도합니다. IL-15 융합 설계는 NK 기억 세포를 모집하여 지속성을 연장하며, IFN-α 프로그램은 혈액암에서 중기 연구를 진행 중입니다. TNF-α 후보 물질은 과거의 전신 독성 문제로 인해 신중하게 진행되고 있으나, 새로운 마스킹 기술이 관심을 다시 불러일으키고 있습니다. IL-21 및 GM-CSF 하이브리드를 포함하는 “기타” 코호트는 면역 조절을 미세 조정하는 조합 페이로드(payload) 추세를 보여줍니다.
치료 영역별:
종양학은 2024년 면역사이토카인 시장 규모의 48.24%를 차지하며, 방광암, 폐암, 흑색종 승인을 통해 항암 효능을 입증했습니다. 그러나 자가면역 및 염증성 질환은 IL-10 및 IL-2 변이체가 광범위한 면역 억제 없이 항원 특이적 내성을 목표로 함에 따라 2030년까지 14.57%의 CAGR로 가장 빠르게 성장할 것입니다. 초기 전신성 홍반성 루푸스(systemic lupus erythematosus) 임상 시험에서는 이중 가닥 DNA 역가 및 스테로이드 요구량 감소가 보고되어 질병 조절 능력을 시사합니다.
전달 방식별:
전신 정맥 주사(Systemic IV)는 임상의의 익숙함, 예측 가능한 약동학, 기존 주입 센터와의 인프라 호환성으로 인해 61.55%의 점유율로 여전히 지배적입니다. 그러나 유전자 및 벡터 인코딩 플랫폼은 mRNA 및 바이러스 시스템이 지속적인 생체 내 사이토카인 발현을 제공하여 투여 빈도와 병원 체류 시간을 줄임에 따라 16.89%의 CAGR로 성장하고 있습니다. 종양 내 주사(Intratumoral injection)는 접근 가능한 병변이 있는 고형암에서 국소 면역원성 세포 사멸 및 항원 확산을 입증하며 모멘텀을 얻고 있습니다.
최종 사용자별:
제약 및 생명공학 기업은 자본 자원, 규제 전문성 및 확립된 판매 네트워크를 활용하여 제품 출시를 가속화하며 2024년 면역사이토카인 시장 점유율의 53.41%를 차지했습니다. 학술 및 연구 기관은 기초 연구에서 임상 적용으로 혁신적인 사이토카인 엔지니어링 개념을 전환하고 이를 산업 파트너에게 라이선스함으로써 2030년까지 15.23%의 CAGR로 가장 빠르게 성장할 것으로 예상됩니다. 이들 대학 기반 센터는 상업적 진입 기업의 개발 주기를 단축하기 위해 신규 구조체의 위험을 줄이는 초기 단계 임상 시험을 수행합니다.
지역 분석
북미는 2024년 시장 점유율의 38.35%를 차지하며 벤처 캐피탈, 학계 및 규제 속도를 연결하는 통합 생태계를 반영합니다. 미국은 자본 위험을 줄이는 우선 심사 바우처 및 희귀의약품 인센티브를 제공하며, 국립암연구소(National Cancer Institute) 네트워크는 첨단 면역 치료제에 경험이 있는 임상 시험 기관을 공급합니다.
아시아 태평양은 규제 기관이 표준을 조화시키고 신속 승인 경로를 확대함에 따라 2030년까지 14.26%의 CAGR로 성장할 것으로 예상됩니다. 호주 의약품 관리국(TGA)은 최초의 PD-1 면역관문억제제 연계 면역사이토카인을 승인하여 국제 데이터 패키지를 활용하려는 지역적 의지를 보여주었습니다. 일본 의약품의료기기종합기구(PMDA)는 사키가케(Sakigake) 신속 심사 지정을 통해 심사 주기를 6개월 단축하여 스폰서들이 현지에서 가교 연구를 수행하도록 유도하고 있습니다.
유럽은 유럽의약품청(EMA)의 중앙 집중식 승인 절차와 강력한 학계-산업 컨소시엄에 힘입어 꾸준한 성장을 유지하고 있습니다. 독일의 바이오엔텍(BioNTech) 주도 생태계는 벡터 인코딩 사이토카인에 적용 가능한 mRNA 노하우를 제공하며, 영국의 MHRA는 첨단 치료제에 유리한 롤링 리뷰(rolling reviews)를 시범 운영하고 있습니다.
경쟁 환경
면역사이토카인 시장은 중간 정도의 집중도를 보이며, 상위 5개 개발사가 전체 수익의 약 45%를 차지하고 있어 후발 주자들에게 상당한 성장 여지가 있습니다. 이뮤니티바이오(ImmunityBio)는 시장 선점 지위와 강력한 제조 규모를 활용하여 점유율을 방어하고 있으며, 넥타 테라퓨틱스(Nektar Therapeutics)는 종양 조건부 활성화 기술로 전환하고 있습니다. 실리오 테라퓨틱스(Xilio Therapeutics)의 프로테아제-활성화 사이토카인과 GT 바이오파마(GT Biopharma)의 TriKE 플랫폼은 종양 미세환경 장벽을 표적으로 하는 특수 엔지니어링을 선보입니다. 브리스톨 마이어스 스큅(Bristol Myers Squibb), 애브비(AbbVie), 사노피(Sanofi)와 같은 대형 제약사들은 라이선싱 계약을 통해 파이프라인을 다각화하고 있습니다.
전략적 초점은 제어 가능성, 국소 전달, 면역관문억제제와의 병용 요법을 통한 차별화에 맞춰져 있습니다. 기업들은 융합 형식, 마스킹 링커 및 벡터 페이로드 아키텍처에 대한 중복 청구를 통해 지적 재산권(IP)의 폭을 넓히는 데 주력하고 있습니다. 소규모 혁신 기업과 숙련된 생물학적 제제 공장 간의 제조 동맹은 스케일업 위험을 완화합니다. 학술 스핀오프 기업들은 파괴적인 아이디어를 육성하며, 벤처 캐피탈(VC) 신디케이트는 종양학, 자가면역 질환 및 감염성 질환을 단일 플랫폼으로 해결할 수 있는 플랫폼 다용도성을 우선시합니다.
최근 산업 동향
* 2025년 7월: 애브비(AbbVie)는 재발성/불응성 다발성 골수종에서 79%의 전체 반응률을 보인 CD38×BCMA×CD3 삼중특이성 항체인 ISB 2001에 대해 이크노스 글렌마크 이노베이션(Ichnos Glenmark Innovation)과 독점적인 전 세계 라이선스 계약을 체결했습니다.
* 2025년 6월: 이뮤니티바이오(ImmunityBio)는 화학방사선 요법을 받는 환자의 림프구 감소증을 역전시키기 위한 안크티바(ANKTIVA)와 CAR-NK 병용 요법에 대해 FDA RMAT(재생의학 첨단치료제) 지정을 받았습니다.
* 2025년 4월: 이뮤니티바이오(ImmunityBio)는 비근침윤성 방광암 환자를 대상으로 한 안크티바(ANKTIVA) + BCG 병용 요법에서 36개월 시점에 71%의 완전 반응률과 84%의 방광 절제술 회피율을 보고했습니다.
* 2025년 2월: 인뮤네 바이오(INmune Bio)는 긍정적인 MissionEB 데이터에 따라 소아 열성 이영양성 수포성 표피박리증(Recessive Dystrophic Epidermolysis Bullosa) 치료를 위한 중간엽 줄기세포 치료제인 CORDStrom에 대한 생물학적 제제 허가 신청(BLA) 계획을 발표했습니다.
이 보고서는 글로벌 면역사이토카인(Immunocytokines) 시장에 대한 심층 분석을 제공합니다. 면역사이토카인은 면역 자극 사이토카인과 표적화 부분(종종 항체 단편)을 연결하는 융합 단백질로, 질병 조직에 직접 사이토카인을 전달하여 국소 면역 활동을 증진시키면서 전신 독성을 제한하는 것을 목표로 합니다.
시장 규모 및 성장 전망:
면역사이토카인 시장은 2025년에 10억 3천만 달러 규모를 기록했으며, 2030년에는 연평균 성장률(CAGR) 12.24%로 성장하여 18억 4천만 달러에 이를 것으로 전망됩니다.
시장 동인:
시장의 성장을 견인하는 주요 요인으로는 IL-2 기반 융합 치료제의 임상적 성공과 이에 따른 투자 유치 증가가 있습니다. 또한, 면역사이토카인과 체크포인트 억제제 병용 요법의 채택이 확산되고 있으며, 제조 플랫폼의 발전으로 생산 비용(COGS)이 절감되고 배치 실패율이 낮아지는 점도 긍정적인 영향을 미치고 있습니다. 자가면역 질환(예: F8-IL10)으로의 파이프라인 확장, 희귀 종양에 대한 희귀의약품 인센티브, 그리고 온디맨드(on-demand) 소분자 스위치형 면역사이토카인 개발 또한 시장 성장을 촉진하고 있습니다.
시장 제약 요인:
반면, 사이토카인 방출 증후군(CRS) 및 관련 안전성 문제, 높은 GMP 스케일업 및 품질 보증/품질 관리(QA/QC) 비용은 시장 성장의 주요 제약 요인으로 작용합니다. 또한, 바이오마커 기반의 환자 계층화가 아직 미흡하며, 이중특이성 항체 및 세포 치료제와 같은 경쟁 모달리티의 부상도 시장에 압력으로 작용하고 있습니다.
주요 시장 세분화 분석:
* 사이토카인 유형별: IL-2 기반 면역사이토카인이 2024년 시장 점유율 39.24%로 가장 큰 비중을 차지하며 시장을 주도하고 있습니다. 이는 방광암 치료제 ANKTIVA의 최초 승인으로 그 유효성이 입증되었습니다. 이 외에도 IL-12, IL-15, IFN-α, TNF-α 기반 면역사이토카인 및 기타 유형(IL-21, GM-CSF, 복합제)이 분석되었습니다.
* 치료 영역별: 종양학 분야가 가장 큰 비중을 차지하며, 자가면역 및 염증성 질환, 감염성 질환, 기타 질환(섬유증, 안과 질환) 등이 포함됩니다.
* 전달 방식별: 전신 정맥 주사(Systemic IV), 종양 내 주사(Intratumoral Injection), 유전자/벡터 인코딩(mRNA, 바이러스 등), 용해성 바이러스 전달(Oncolytic-virus Delivered) 방식이 검토되었습니다.
* 최종 사용자별: 제약 및 바이오 기업, 학술 및 연구 기관, 위탁 생산 기관(CMO), 병원/전문 클리닉 등이 주요 최종 사용자입니다.
* 지역별: 아시아-태평양 지역은 2030년까지 연평균 14.26%의 가장 빠른 성장률을 보일 것으로 예상됩니다. 이는 신속한 규제 검토, 호주, 일본, 중국, 인도 등에서의 임상 시험 역량 확대, 그리고 전략적 제조 파트너십 증가에 기인합니다. 북미, 유럽, 중동 및 아프리카, 남미 지역도 상세히 분석되었습니다.
경쟁 환경:
보고서는 시장 집중도, 시장 점유율 분석을 포함한 경쟁 환경을 다루며, Philogen S.p.A., Nektar Therapeutics, ImmunityBio Inc., F. Hoffmann-La Roche AG, Novartis AG, Bristol Myers Squibb Co., Sanofi S.A. 등 주요 19개 기업의 프로필을 제공합니다.
시장 기회 및 미래 전망:
면역사이토카인 시장은 미충족 수요가 높은 분야에서 상당한 성장 기회를 가지고 있습니다. 개발자들은 사이토카인 방출 증후군과 같은 안전성 위험을 완화하기 위해 용량 적정, 바이오마커 모니터링, 온디맨드 활성 설계 등 다양한 전략을 활용하고 있습니다. 이러한 노력은 면역사이토카인이 국소 면역 반응을 강화하고 전신 독성을 줄이는 혁신적인 치료제로 자리매김하는 데 기여할 것입니다.

1. 서론
- 1.1 연구 가정 및 시장 정의
- 1.2 연구 범위
2. 연구 방법론
3. 요약
4. 시장 환경
- 4.1 시장 개요
- 4.2 시장 동인
- 4.2.1 IL-2 기반 융합 치료제의 임상적 성공이 투자 자금 유치
- 4.2.2 면역사이토카인 + 면역관문억제제 요법의 채택 증가
- 4.2.3 제조 플랫폼 발전으로 COGS 및 배치 실패 감소
- 4.2.4 자가면역 질환 적응증으로 파이프라인 확장 (예: F8-IL10)
- 4.2.5 희귀 종양에 대한 희귀의약품 인센티브
- 4.2.6 온디맨드, 저분자 전환 가능 면역사이토카인
- 4.3 시장 제약
- 4.3.1 사이토카인 방출 증후군 및 관련 안전 문제
- 4.3.2 높은 GMP 스케일업 및 QA/QC 비용
- 4.3.3 불충분한 바이오마커 기반 환자 계층화
- 4.3.4 이중특이성 및 세포 치료 양식의 경쟁적 압력
- 4.4 가치 / 공급망 분석
- 4.5 규제 환경
- 4.6 기술 전망
- 4.7 포터의 5가지 경쟁 요인 분석
- 4.7.1 공급업체의 교섭력
- 4.7.2 구매자의 교섭력
- 4.7.3 신규 진입자의 위협
- 4.7.4 대체재의 위협
- 4.7.5 경쟁 강도
5. 시장 규모 및 성장 예측 (가치-USD)
- 5.1 사이토카인 유형별
- 5.1.1 IL-2 기반 면역사이토카인
- 5.1.2 IL-12 기반 면역사이토카인
- 5.1.3 IL-15 기반 면역사이토카인
- 5.1.4 IFN-α 기반 면역사이토카인
- 5.1.5 TNF-α 기반 면역사이토카인
- 5.1.6 기타 (IL-21, GM-CSF, 복합)
- 5.2 치료 영역별
- 5.2.1 종양학
- 5.2.2 자가면역 & 염증성 질환
- 5.2.3 감염성 질환
- 5.2.4 기타 (섬유증, 안과학)
- 5.3 전달 방식별
- 5.3.1 전신 정맥 주사
- 5.3.2 종양 내 주사
- 5.3.3 유전자 / 벡터 인코딩 (예: mRNA, 바이러스)
- 5.3.4 용해성 바이러스 전달
- 5.4 최종 사용자별
- 5.4.1 제약 & 생명공학 기업
- 5.4.2 학술 & 연구 기관
- 5.4.3 위탁 생산 기관
- 5.4.4 병원 / 전문 클리닉
- 5.5 지역별
- 5.5.1 북미
- 5.5.1.1 미국
- 5.5.1.2 캐나다
- 5.5.1.3 멕시코
- 5.5.2 유럽
- 5.5.2.1 독일
- 5.5.2.2 영국
- 5.5.2.3 프랑스
- 5.5.2.4 이탈리아
- 5.5.2.5 스페인
- 5.5.2.6 기타 유럽
- 5.5.3 아시아 태평양
- 5.5.3.1 중국
- 5.5.3.2 일본
- 5.5.3.3 인도
- 5.5.3.4 호주
- 5.5.3.5 대한민국
- 5.5.3.6 기타 아시아 태평양
- 5.5.4 중동 및 아프리카
- 5.5.4.1 GCC
- 5.5.4.2 남아프리카
- 5.5.4.3 기타 중동 및 아프리카
- 5.5.5 남미
- 5.5.5.1 브라질
- 5.5.5.2 아르헨티나
- 5.5.5.3 기타 남미
6. 경쟁 환경
- 6.1 시장 집중도
- 6.2 시장 점유율 분석
- 6.3 기업 프로필 (글로벌 개요, 시장 개요, 핵심 부문, 재무 정보(사용 가능한 경우), 전략 정보, 주요 기업의 시장 순위/점유율, 제품 및 서비스, 최근 개발 포함)
- 6.3.1 Philogen S.p.A.
- 6.3.2 Nektar Therapeutics
- 6.3.3 ImmunityBio Inc.
- 6.3.4 F. Hoffmann-La Roche AG
- 6.3.5 Novartis AG
- 6.3.6 Bristol Myers Squibb Co.
- 6.3.7 Sanofi S.A.
- 6.3.8 Xilio Therapeutics
- 6.3.9 Sorrento Therapeutics
- 6.3.10 Alkermes plc
- 6.3.11 Regeneron Pharmaceuticals
- 6.3.12 AbbVie Inc.
- 6.3.13 Amgen Inc.
- 6.3.14 AstraZeneca plc
- 6.3.15 Merck & Co.
- 6.3.16 Affimed N.V.
- 6.3.17 SynOx Therapeutics
- 6.3.18 Oncotelic Therapeutics
- 6.3.19 Sutro Biopharma
7. 시장 기회 & 미래 전망
❖본 조사 보고서에 관한 문의는 여기로 연락주세요.❖
이뮤노사이토카인은 면역글로불린, 즉 항체와 사이토카인을 유전공학적으로 융합하여 개발된 차세대 바이오 의약품을 의미합니다. 이는 항체의 특정 항원에 대한 높은 결합 특이성과 사이토카인의 강력한 면역 조절 기능을 결합하여, 사이토카인이 원하는 질병 부위, 특히 종양 미세환경에 선택적으로 전달되도록 설계된 치료제입니다. 기존 사이토카인 치료제가 전신 투여 시 나타나는 심각한 부작용과 짧은 반감기 등의 한계를 극복하고, 치료 효능을 극대화하는 것을 목표로 합니다.
이뮤노사이토카인의 종류는 융합 방식과 사용되는 사이토카인의 종류에 따라 다양하게 분류될 수 있습니다. 융합 방식으로는 항체 전체 또는 항원 결합 단편(예: scFv)에 사이토카인을 직접 융합하는 형태, 혹은 항체의 Fc 부위에 사이토카인을 융합하는 형태 등이 있습니다. 사용되는 사이토카인의 종류에 따라서는 인터루킨-2(IL-2), 인터루킨-12(IL-12), 인터루킨-15(IL-15), 종양괴사인자 알파(TNF-α), 과립구-대식세포 콜로니 자극인자(GM-CSF) 등 다양한 사이토카인이 활용됩니다. 각 사이토카인은 T세포 활성화, NK세포 증식, Th1 반응 유도, 항원 제시 세포 활성화 등 고유한 면역 조절 기능을 가지고 있어, 치료 목적에 따라 적절한 사이토카인이 선택됩니다.
주요 활용 분야는 단연 항암 치료입니다. 이뮤노사이토카인은 종양 특이 항원에 결합하여 사이토카인을 종양 미세환경에 집중시킴으로써, 주변의 면역세포(T세포, NK세포 등)를 활성화하고 종양 세포의 사멸을 유도합니다. 이는 기존 면역관문억제제와 병용 시 시너지 효과를 창출하여 치료 반응률을 높일 수 있는 잠재력을 가지고 있습니다. 고형암뿐만 아니라 혈액암 등 다양한 암종에 대한 적용 가능성이 활발히 연구되고 있습니다. 또한, 특정 면역 반응을 조절하는 사이토카인을 활용하여 자가면역질환의 염증 반응을 제어하거나, 감염성 질환에서 특정 병원체에 대한 면역 반응을 강화하는 치료제로도 개발 가능성이 탐색되고 있습니다.
이뮤노사이토카인 개발에는 여러 첨단 기술이 복합적으로 요구됩니다. 핵심은 유전공학 및 단백질 공학 기술로, 항체와 사이토카인의 유전자를 정교하게 융합하고 이를 효율적으로 발현시키는 기술입니다. 특정 항원에 대한 높은 친화도와 특이성을 가진 항체를 개발하는 항체 공학 기술, 그리고 각 사이토카인의 생물학적 기능과 신호 전달 경로에 대한 깊은 이해를 바탕으로 최적의 치료 전략을 수립하는 사이토카인 생물학이 필수적입니다. 더불어, 이뮤노사이토카인의 생체 내 안정성, 반감기, 분포를 최적화하는 약물 전달 시스템 기술과 대량 생산 및 고순도 정제를 위한 바이오 공정 기술 또한 중요한 관련 기술로 손꼽힙니다.
시장 배경을 살펴보면, 면역항암제 시장의 폭발적인 성장과 함께 이뮤노사이토카인은 차세대 면역치료제로서 큰 주목을 받고 있습니다. 다수의 글로벌 제약사와 바이오텍 기업들이 이 분야에 막대한 투자를 진행하며 초기 및 중기 임상 시험이 활발히 이루어지고 있습니다. 그러나 여전히 사이토카인의 전신 부작용을 완전히 제어하는 문제, 최적의 용량 및 투여 경로 설정, 그리고 복잡한 생산 공정으로 인한 높은 생산 비용 등은 해결해야 할 도전 과제로 남아 있습니다. 아직 상용화된 제품이 많지 않아 정확한 시장 규모를 예측하기는 어렵지만, 면역항암제 시장의 한 축으로서 매우 큰 성장 잠재력을 보유하고 있습니다.
미래 전망은 매우 밝습니다. 이뮤노사이토카인은 면역관문억제제, CAR-T 치료제, 항암 백신 등 다른 면역치료제와의 병용 요법을 통해 치료 효과를 극대화하는 방향으로 발전할 것입니다. 또한, 약동학적 특성이 더욱 개선되고 면역원성이 낮은 차세대 이뮤노사이토카인 개발이 가속화될 것으로 예상됩니다. 다중 타겟팅 및 다중 사이토카인 융합을 통한 복합 치료 효과를 노리거나, 종양 미세환경 특이적 활성화 메커니즘을 도입하여 부작용을 최소화하는 연구도 활발히 진행될 것입니다. 항암 분야를 넘어 자가면역질환, 감염성 질환 등으로 적응증이 확대될 가능성도 크며, 인공지능(AI) 및 머신러닝 기술을 활용하여 최적의 이뮤노사이토카인 설계 및 예측 기술이 도입되는 등 정밀 의학과의 결합을 통해 환자 맞춤형 치료 전략이 더욱 고도화될 것으로 기대됩니다.