❖본 조사 보고서의 견적의뢰 / 샘플 / 구입 / 질문 폼❖
구조 생물학 및 분자 모델링 기술 시장 개요: 2026-2031년 성장 동향 및 전망
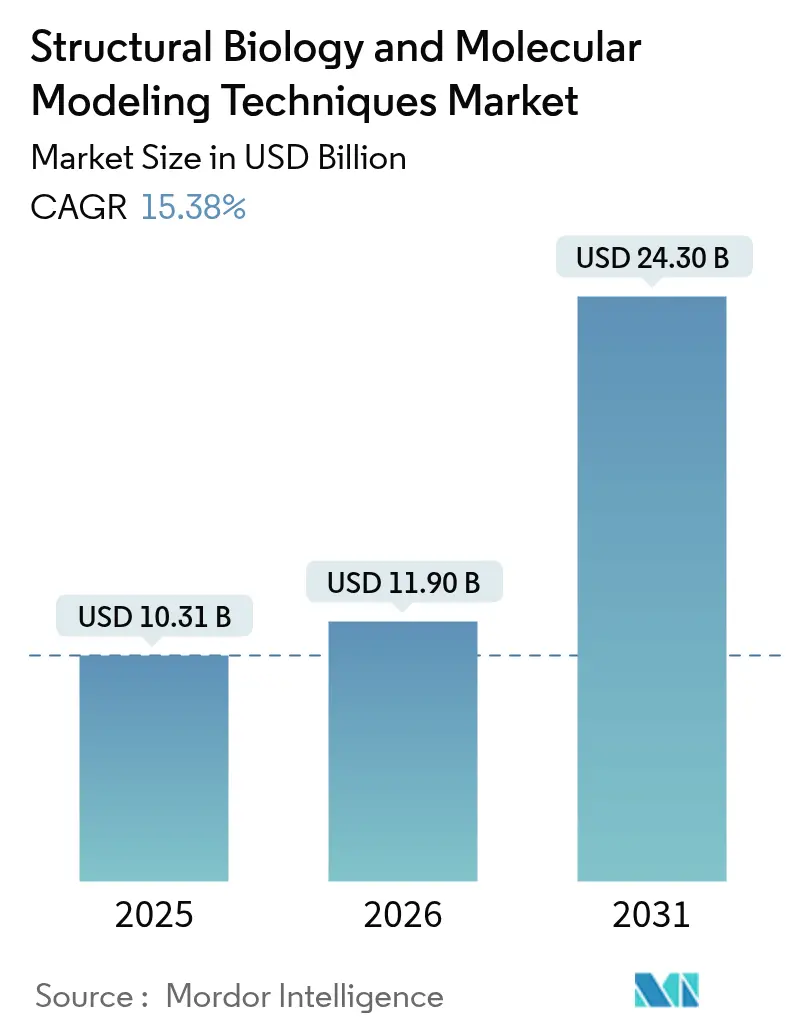
구조 생물학 및 분자 모델링 기술 시장은 2025년 103.1억 달러에서 2026년 119억 달러로 성장했으며, 2031년에는 243억 달러에 달할 것으로 예상됩니다. 이는 2026년부터 2031년까지 연평균 성장률(CAGR) 15.38%를 기록할 것입니다. 이러한 확장은 인공지능(AI)과 물리 기반 시뮬레이션의 빠른 융합에 힘입어 제약 회사들이 신약 발굴 기간을 단축하고 전임상 비용을 절감할 수 있게 된 데 기인합니다. 2025년 1월, AI 결과물을 1차 증거로 인정하는 미국 식품의약국(FDA)의 지침 초안은 계산 결과의 제도화를 촉진하여 모델 기반 제출의 길을 열었습니다.
양자 준비 소프트웨어 스택 및 클라우드 네이티브 플랫폼에 대한 벤처 투자는 상업화를 가속화하고 있으며, 고해상도 극저온 전자 현미경(cryo-EM) 데이터 스트림은 점점 더 큰 훈련 세트를 제공하고 있습니다. 경쟁 역학은 시각화 스위트, 시뮬레이션 엔진 및 머신러닝 모델을 안전한 구독 기반 서비스로 통합할 수 있는 공급업체에 유리하게 작용하고 있습니다. 중소 규모의 생명공학 기업과 학술 연구소는 이제 웹 포털을 통해 엔터프라이즈급 리소스에 접근하여 혁신을 민주화하고 구조 생물학 및 분자 모델링 기술 시장의 잠재 고객 기반을 확대하고 있습니다.
주요 보고서 요약:
* 도구별: 2025년 SaaS 플랫폼이 41.02%의 매출 점유율로 시장을 주도했으며, 시각화 및 분석 스위트는 2031년까지 16.24%의 CAGR로 성장할 것으로 전망됩니다.
* 애플리케이션별: 2025년 신약 발굴이 구조 생물학 및 분자 모델링 기술 시장 점유율의 52.88%를 차지했으며, 신약 개발 및 선도 물질 최적화는 2031년까지 16.49%의 CAGR로 성장할 것으로 예상됩니다.
* 최종 사용자별: 2025년 제약 및 생명공학 기업이 구조 생물학 및 분자 모델링 기술 시장 규모의 61.34%를 차지했으며, 학술 및 정부 기관은 16.74%의 CAGR로 가장 빠른 성장 궤도를 보이고 있습니다.
* 지역별: 2025년 북미가 구조 생물학 및 분자 모델링 기술 시장의 40.41%를 차지했으며, 아시아 태평양 지역은 2031년까지 16.21%의 CAGR로 가장 빠른 성장을 기록할 것으로 예상됩니다.
# 글로벌 구조 생물학 및 분자 모델링 기술 시장 동향 및 통찰력
주요 시장 동인:
* AI 기반 신약 발굴 플랫폼의 빠른 채택 (+3.2% CAGR 영향): 일라이 릴리(Eli Lilly)의 양자 화학 스타트업에 대한 10억 달러 투자와 같은 사례는 주요 제약사들이 머신러닝 앙상블에 전적인 신약 발굴 파이프라인을 할애하고 있음을 보여줍니다. AlphaFold 3, Boltz-2와 같은 도구의 광범위한 배포는 과거 수년이 걸리던 입체 구조 탐색을 병렬적으로 가능하게 합니다. FDA의 AI 결과물을 1차 증거로 인정하는 지침 초안은 계산 결과의 제도화를 촉진하여 전임상 단계의 실패율을 30~40% 낮추는 효과를 가져옵니다. 공급업체들은 분자 동역학, 도킹, 그래프 신경망을 통합된 작업 공간에 통합하여 화학자들이 실시간으로 설계를 반복할 수 있도록 지원하며, 경쟁 우위는 단일 독점 엔진보다는 여러 AI 모델의 결과물을 조율하는 능력에 점점 더 좌우되고 있습니다.
* 만성 질환 유병률 증가 (+2.8% CAGR 영향): 신경 퇴행성 질환, 종양학 및 대사 장애는 구조 기반 모델링만이 지원할 수 있는 다중 약물 요법 접근 방식을 요구합니다. 2024년 발표된 FDA의 종양학 용량 지침은 임상 1상 시험 전에 예측 노출-반응 시뮬레이션의 필요성을 강조합니다. 다중 표적 알고리즘은 상호 연결된 경로 전반에 걸쳐 결합 친화도를 최적화하는 동시에 비표적 위험을 모니터링합니다. 만성 질환의 복잡성이 증가함에 따라 시뮬레이션 속도뿐만 아니라 깊이 또한 중요해지면서 고정밀 하이브리드 양자 역학 방법의 채택이 더욱 가속화되고 있습니다.
* 극저온 전자 현미경(Cryo-EM) 및 고해상도 이미징 기술 발전 (+2.5% CAGR 영향): 2옹스트롬(Å) 미만의 극저온 전자 현미경 재구성은 과거 추론적 결정학 모델에 의존했던 원자 수준의 약물 결합을 이제 직접적으로 보여줍니다. 클라우드 호스팅 이미지 처리 파이프라인은 처리 시간을 몇 달에서 며칠로 단축하여 소규모 생명공학 기업도 온프레미스 하드웨어 없이 국립 시설 데이터를 활용할 수 있게 합니다. AI 강화 입자 선택 및 맵 정제는 다운스트림 분자 동역학에 직접적으로 연결되어 시뮬레이션 입력이 자연적인 형태를 반영하도록 보장합니다. 이러한 이미징과 모델링 간의 시너지는 표적 검증을 강화하여 비용이 많이 드는 후기 단계의 전환을 줄입니다.
* 클라우드 네이티브 협업 연구 환경의 성장 (+2.1% CAGR 영향): 하이퍼스케일(hyperscale) 제공업체의 온디맨드 인프라는 수천 개의 병렬 궤적을 지원하여 과거 탐색 깊이를 제한했던 컴퓨팅 한계를 제거합니다. 보안 작업 공간은 기관 간 컨소시엄이 세분화된 접근 제어 하에 지적 재산을 보호하면서 선도 물질 시리즈를 공동 개발할 수 있도록 합니다. 탄력적인 클러스터는 제출 시 GPU 가속 분자 동역학을 시작하여 지출을 작업량에 맞추고 예산에 민감한 학술 연구소의 참여를 확대합니다.
시장 제약 요인:
* 정교한 장비의 높은 비용 (-1.8% CAGR 영향): 첨단 극저온 전자 현미경 시스템과 고성능 컴퓨팅 클러스터는 1천만 달러를 초과하는 초기 자본 투자를 필요로 하며, 이는 소규모 연구 기관이나 신흥 시장 기관에 상당한 진입 장벽으로 작용합니다. 운영 비용 또한 초기 장비 구매를 넘어 전문 시설 요구 사항, 유지보수 계약, 지속적인 소프트웨어 라이선스 비용을 포함하며, 이는 연간 연구 예산의 40~50%를 차지할 수 있습니다. 클라우드 기반 대안이 이러한 문제를 부분적으로 해결하지만, 데이터 전송 비용과 지연 시간 문제는 실시간 협업 연구의 효율성을 제한합니다.
* 다학제적 숙련 인력 부족 (-1.5% CAGR 영향): 구조 생물학, 계산 화학 및 인공지능의 융합은 분자 메커니즘과 고급 컴퓨팅 방법론을 모두 이해하는 전문가에 대한 전례 없는 수요를 창출합니다. 대학들은 단백질 생화학, 머신러닝 알고리즘 및 규제 과학에 대한 전문 지식을 동시에 요구하는 역할에 졸업생을 적절하게 준비시키는 커리큘럼을 개발하는 데 어려움을 겪고 있습니다. 이러한 인력 부족은 특히 신약 발굴을 위한 AI 모델 개발에 영향을 미치며, 분자 생물학과 데이터 과학 모두에 대한 도메인 전문 지식이 모델 정확도와 규제 승인을 결정합니다.
* 국경 간 협력에 대한 데이터 주권 제한 (-1.2% CAGR 영향): 유럽연합(EU) 및 아시아 태평양(APAC) 지역을 중심으로 데이터 주권 지침은 다중 지역 데이터 레이크를 복잡하게 만들 수 있습니다.
* AI 기반 분자 모델링의 알고리즘 편향 (-0.9% CAGR 영향): AI 모델의 알고리즘 편향은 결과의 신뢰성과 공정성에 대한 우려를 제기하며, 특히 북미 및 EU 지역에서 규제 당국의 높은 관심을 받고 있습니다.
# 세그먼트 분석
도구별: SaaS 플랫폼이 시장 통합을 주도
SaaS 및 독립형 플랫폼은 2025년 41.02%의 가치를 차지하며, 신규 진입 기업의 자본 장벽을 완화하는 구독 경제의 중요성을 강조합니다. 이 중 고처리량 분자 동역학 엔진이 일일 사용량 지표를 주도하며, 양자 역학 솔버는 서브-kcal/mol 정확도를 요구하는 특정 프로그램에서 활용됩니다. 시각화 및 분석 스위트는 16.24%의 CAGR로 다른 모든 도구 유형을 능가하며, 코딩 경험이 없는 의약 화학자, 구조 생물학자 및 데이터 과학자들이 입체 구조 앙상블을 공동으로 탐색할 수 있도록 하는 직관적인 GUI에 힘입어 성장하고 있습니다. VTX 및 OpenMMDL과 같은 오픈 소스 진입자들은 접근성을 확대하고 독점 시장 지배력을 약화시키고 있습니다. GPU 렌더링 비용이 감소하고 클라우드 제공이 보편화됨에 따라 시각화 스위트 시장 규모는 꾸준히 확대될 것으로 예상됩니다. 공급업체 전략은 도킹, 자유 에너지 계산 및 AI 기반 속성 예측을 통합된 인증 및 청구 시스템 하에 묶는 통합 생태계에 집중되고 있습니다.
애플리케이션별: 신약 개발이 발굴 단계를 넘어 가속화
신약 발굴은 2025년 52.88%의 점유율을 유지했지만, 신약 개발 및 선도 물질 최적화는 16.49%의 CAGR로 가장 빠른 성장을 기록하며 모델 기반 프로토콜에 대한 규제 승인을 반영합니다. 스폰서들은 노출-반응 시뮬레이터를 구조 예측과 통합하여 임상 1상에서 용량 제한 독성을 미리 방지합니다. 단백질 공학 또한 반감기 연장 및 면역원성 최소화를 위한 스캐폴드 재설계로 빠르게 발전하고 있습니다. 검증된 AI 파이프라인이 후기 단계 워크플로우로 전환됨에 따라 신약 개발 단계의 구조 생물학 및 분자 모델링 기술 시장 규모는 2030년 이전에 두 배로 증가할 것으로 예상됩니다. 임상 통계학자들은 이제 모델러와 직접 협력하여 시험관 내 약동학 프로파일을 기반으로 적응형 임상 시험 매개변수를 설정합니다.
최종 사용자별: 학술 기관이 산업 지배력에 도전
제약 및 생명공학 기업은 2025년 61.34%의 점유율을 유지했지만, 학술 및 정부 기관은 16.74%의 CAGR로 성장하고 있습니다. 국립 과학 기관들은 팬데믹 대비, 기후 관련 병원체 연구 및 희귀 질환 이니셔티브에 새로운 보조금을 지원하고 있으며, 이 모든 것은 구조적 통찰력을 요구합니다. 따라서 산업 지출이 확대됨에도 불구하고 학계의 구조 생물학 및 분자 모델링 기술 시장 점유율은 증가하고 있습니다. 계약 연구 기관(CRO)은 모델링 전문 지식을 내재화한 새로운 서비스 라인을 개발하여 소규모 생명공학 기업이 내부 인력을 확보하지 않고도 전체 시뮬레이션 캠페인을 아웃소싱할 수 있도록 합니다. 소프트웨어 공급업체는 공동 개발 협력자로 변모하고 있으며, Schrödinger가 순수 소프트웨어 판매자가 아닌 공동 파이프라인 설계자로서 23억 달러 규모의 협력을 진행한 사례가 이를 증명합니다.
# 지역 분석
* 북미: 2025년 전 세계 매출의 40.41%를 차지했으며, 국립보건원(NIH) 예산 증가와 AI 생성 증거를 명시적으로 수용하는 규제 문화에 힘입어 성장했습니다. 보스턴, 샌디에이고, 토론토의 고밀도 클러스터는 스타트업에게 비옥한 토양을 제공하지만, 클라우드 비용 상승과 임금 인플레이션은 초기 단계 벤처의 지속 가능성 마진을 시험하고 있습니다.
* 유럽: 공공-민간 협력 이니셔티브와 2024년 9월 유럽의약품청(EMA)의 AI 거버넌스 조화에 대한 반성 보고서를 통해 꾸준한 성장세를 유지하고 있습니다. 데이터 주권 지침이 다중 지역 데이터 레이크를 복잡하게 만들지만, 국내 호스팅 클라우드가 규제 준수 격차를 완화합니다.
* 아시아 태평양: 16.21%의 CAGR로 가장 빠른 성장 궤도를 보이고 있습니다. 중국의 양자 컴퓨팅 연구소는 신약 발굴 알고리즘에 국가 인센티브를 집중하고 있으며, 일본의 극저온 전자 현미경 인프라 리더십은 세계적 수준의 슈퍼컴퓨터와 결합하여 고정밀 구조 세트를 생산하여 지역 AI 노력을 지원합니다. 인도는 클라우드 우선 생명공학 인큐베이터를 확장하여 소프트웨어 엔지니어링 역량을 비용 효율적인 시뮬레이션 서비스로 전환하고 있습니다. 한국과 호주는 각각 바이오센서 및 번역 유전체학과 같은 틈새 강점에 집중하여 그 결과물을 더 넓은 지역 생태계에 통합하고 있습니다.
* 중동, 아프리카 및 남미: 초기 단계이지만 유망한 채택 곡선을 기록하고 있습니다. 걸프 지역의 정부 기술 자유 구역은 세금 인센티브를 통해 서구 소프트웨어 파트너를 유치하고 있으며, 브라질은 공립 대학 네트워크를 활용하여 농업 생물 다양성 모델링을 수행합니다.
# 경쟁 환경
현재 시장은 중간 정도의 집중도를 보이며, 상위 5개 공급업체가 상당한 점유율을 차지하고 있지만 지배적이지는 않습니다. Schrödinger, Dassault BIOVIA, Certara와 같은 주요 기업들은 AI 가속기와 기존 물리 엔진을 결합하여 기업 입지를 확장하고 있습니다. 이들의 파트너십 기반 신약 개발로의 전환은 노바티스와의 다년간 계약과 같이 라이선스 볼륨보다는 파이프라인 진행에 따른 마일스톤 지급을 연계하는 방식과 유사합니다. 이러한 하이브리드 계약은 소프트웨어 전문 지식을 고객 R&D 깊숙이 통합하여 워크플로우 의존도를 고착화합니다.
양자 하드웨어 발전은 전자 구조 문제에 대한 엄청난 속도 향상을 내세우며 시장을 교란하고 있습니다. QuEra-Quantum Intelligence 협약과 같은 제휴는 고전적인 HPC 노드의 스케일링 한계를 우회하는 게이트 기반 루틴을 상업화하는 것을 목표로 합니다. 오픈 소스 운동은 진입 장벽을 더욱 낮추고 있으며, 커뮤니티에서 유지 관리되는 패키지는 한계 비용으로 분산 GPU 클라우드를 조율하여 현금이 부족한 학계 및 스타트업에게 매력적입니다.
규제 준수 자격은 경쟁력 있는 통화로 부상하고 있습니다. FDA MIDD(Model-Informed Drug Development) 및 EMA AI 반성 지침에 도구 체인을 맞추는 공급업체는 고객의 다운스트림 검증 비용을 절감합니다. 기능 로드맵은 모델 거버넌스 대시보드, 버전 관리된 출처 및 감사 로그를 점점 더 많이 포함하고 있습니다. 가격 책정은 클라우드 경제를 반영하고 구조 생물학 및 분자 모델링 기술 시장에서 광범위하게 다양한 포트폴리오 규모에 걸쳐 탄력적인 배포를 가능하게 하는 사용량 기반 측정으로 전환되고 있습니다.
주요 산업 리더:
* Agilent Technologies, Inc.
* Dassault Systèmes (BIOVIA)
* Thermo Fisher Scientific Inc.
* Schrödinger Inc.
* Certara
최근 산업 동향:
* 2025년 6월: 매사추세츠 공과대학교(MIT) 자밀 클리닉(Jameel Clinic)의 연구원들은 상업적 신약 발굴을 민주화하기 위해 분자 결합 친화도를 전례 없는 속도와 정확도로 예측하는 오픈 소스 모델인 Boltz-2의 출시를 발표했습니다.
* 2025년 1월: Acellera Therapeutics와 Psivant Therapeutics는 AI 및 양자 시뮬레이션을 활용한 혁신적인 계산 신약 발굴 접근 방식을 개발하기 위한 협력을 발표했습니다. 이는 Acellera의 AceForce 기술과 Psivant의 QUAISAR 플랫폼을 결합하여 단백질-리간드 효능 예측을 강화하는 것을 목표로 합니다.
본 보고서는 생체 고분자의 3차원 구조 분석을 위한 강력한 방법론인 분자 모델링 기술 시장에 대한 포괄적인 분석을 제공합니다. 분자 모델링은 NMR 분광법 및 X선 결정학을 통한 구조 결정의 필수적인 구성 요소로 활용됩니다.
1. 시장 규모 및 성장 전망:
구조 생물학 및 분자 모델링 기술 시장은 2026년 119억 달러 규모에서 2031년까지 243억 달러에 이를 것으로 전망되며, 이는 상당한 성장세를 나타냅니다.
2. 시장 동인:
시장의 성장을 견인하는 주요 요인으로는 ▲AI 기반 신약 발굴 플랫폼의 빠른 도입 ▲만성 질환 유병률 증가 ▲극저온 전자현미경(Cryo-EM) 및 고해상도 이미징 기술 발전 ▲클라우드 기반 협업 연구 환경 확산 ▲디지털 트윈 단백질을 활용한 인실리코(in-silico) 독성 스크리닝 증가 ▲개방형 구조 데이터베이스를 통한 분산형 혁신 활성화 등이 있습니다.
3. 시장 제약 요인:
반면, 시장 성장을 저해하는 요인으로는 ▲고가 정밀 장비 비용 ▲다학제적 숙련 인력 부족 ▲데이터 주권으로 인한 국가 간 협력 제한 ▲AI 기반 분자 모델링의 알고리즘 편향성 등이 지적됩니다.
4. 시장 세분화:
* 도구별: 시장은 서비스형 소프트웨어(SaaS) 및 독립형 플랫폼(상동성 모델링, 스레딩/폴드 인식, 분자 동역학 시뮬레이션, 양자 역학/하이브리드 방법 등), 시각화 및 분석 스위트, 기타 도구로 나뉩니다. 특히 시각화 및 분석 스위트 부문은 2031년까지 연평균 16.24%로 가장 빠르게 성장할 것으로 예상됩니다.
* 적용 분야별: 신약 발굴, 신약 개발/선도 물질 최적화, 단백질 공학 및 합성 생물학, 기타 적용 분야로 구분됩니다.
* 최종 사용자별: 제약 및 생명공학 기업, 계약 연구 기관(CRO), 학술 및 정부 기관, 소프트웨어 공급업체 및 플랫폼 제공업체로 구성됩니다. 이 중 제약 및 생명공학 기업이 2025년 전체 지출의 61.34%를 차지하며 가장 큰 비중을 보입니다.
* 지역별: 북미, 유럽, 아시아-태평양, 중동 및 아프리카, 남미로 분류됩니다. 아시아-태평양 지역은 정부 지원 양자 컴퓨팅 투자와 Cryo-EM 역량 확대로 인해 연평균 16.21%의 가장 빠른 성장률을 기록할 것으로 전망됩니다.
5. 규제 환경 및 협력 모델:
2024-2025년에 발표된 미국 식품의약국(FDA) 및 유럽 의약품청(EMA)의 지침에 따라, 검증된 AI 산출물은 제출 시 허용 가능한 1차 증거로 인정되고 있습니다. 또한, 소프트웨어 공급업체와 신약 개발사 간에는 슈뢰딩거(Schrödinger)와 노바티스(Novartis)의 23억 달러 규모 계약과 같이 파이프라인 이정표를 공동 소유하는 다년간의 성과 기반 파트너십이 일반화되고 있습니다.
6. 경쟁 환경:
보고서는 시장 집중도, 시장 점유율 분석, 그리고 슈뢰딩거(Schrödinger Inc.), 다쏘 시스템(Dassault Systèmes), 써모 피셔 사이언티픽(Thermo Fisher Scientific Inc.) 등 주요 기업들의 프로필을 상세히 다룹니다.
본 보고서는 2026년 1월 20일 최종 업데이트되었습니다.

1. 서론
- 1.1 연구 가정 및 시장 정의
- 1.2 연구 범위
2. 연구 방법론
3. 요약
4. 시장 환경
- 4.1 시장 개요
- 4.2 시장 동인
- 4.2.1 AI 기반 신약 개발 플랫폼의 빠른 채택
- 4.2.2 만성 질환 유병률 증가
- 4.2.3 극저온 전자현미경(Cryo-EM) 및 고해상도 이미징 기술 발전
- 4.2.4 클라우드 네이티브 협업 연구 환경의 성장
- 4.2.5 인실리코 독성 스크리닝을 위한 디지털 트윈 단백질 사용 증가
- 4.2.6 분산형 혁신을 가능하게 하는 오픈 액세스 구조 데이터베이스
- 4.3 시장 제약
- 4.3.1 정교한 장비의 높은 비용
- 4.3.2 다학제적 숙련 인력 부족
- 4.3.3 국경 간 협력에 대한 데이터 주권 제한
- 4.3.4 AI 기반 분자 모델링의 알고리즘 편향
- 4.4 규제 환경
- 4.5 기술 전망
- 4.6 포터의 5가지 경쟁 요인 분석
- 4.6.1 신규 진입자의 위협
- 4.6.2 구매자의 교섭력
- 4.6.3 공급자의 교섭력
- 4.6.4 대체재의 위협
- 4.6.5 경쟁 강도
5. 시장 규모 및 성장 예측 (가치)
- 5.1 도구별
- 5.1.1 서비스형 소프트웨어(SaaS) & 독립형 플랫폼
- 5.1.1.1 상동성 모델링
- 5.1.1.2 스레딩 / 접힘 인식
- 5.1.1.3 분자 동역학 시뮬레이션
- 5.1.1.4 양자 역학 / 하이브리드 방법
- 5.1.2 시각화 & 분석 스위트
- 5.1.3 기타 도구
- 5.2 애플리케이션별
- 5.2.1 신약 발굴
- 5.2.2 신약 개발 / 선도 물질 최적화
- 5.2.3 단백질 공학 & 합성 생물학
- 5.2.4 기타 애플리케이션
- 5.3 최종 사용자별
- 5.3.1 제약 & 생명공학 기업
- 5.3.2 계약 연구 기관
- 5.3.3 학술 & 정부 기관
- 5.3.4 소프트웨어 공급업체 & 플랫폼 제공업체
- 5.4 지역별
- 5.4.1 북미
- 5.4.1.1 미국
- 5.4.1.2 캐나다
- 5.4.1.3 멕시코
- 5.4.2 유럽
- 5.4.2.1 독일
- 5.4.2.2 영국
- 5.4.2.3 프랑스
- 5.4.2.4 이탈리아
- 5.4.2.5 스페인
- 5.4.2.6 유럽 기타 지역
- 5.4.3 아시아 태평양
- 5.4.3.1 중국
- 5.4.3.2 일본
- 5.4.3.3 인도
- 5.4.3.4 호주
- 5.4.3.5 대한민국
- 5.4.3.6 아시아 태평양 기타 지역
- 5.4.4 중동 및 아프리카
- 5.4.4.1 GCC
- 5.4.4.2 남아프리카 공화국
- 5.4.4.3 중동 및 아프리카 기타 지역
- 5.4.5 남미
- 5.4.5.1 브라질
- 5.4.5.2 아르헨티나
- 5.4.5.3 남미 기타 지역
6. 경쟁 환경
- 6.1 시장 집중도
- 6.2 시장 점유율 분석
- 6.3 기업 프로필 (글로벌 수준 개요, 시장 수준 개요, 핵심 부문, 가용 재무 정보, 전략 정보, 주요 기업 시장 순위/점유율, 제품 및 서비스, 최근 개발 포함)
- 6.3.1 Schrödinger Inc.
- 6.3.2 Dassault Systèmes (BIOVIA)
- 6.3.3 Thermo Fisher Scientific Inc.
- 6.3.4 Agilent Technologies, Inc.
- 6.3.5 Illumina Inc.
- 6.3.6 Bruker Corporation
- 6.3.7 Chemical Computing Group
- 6.3.8 PerkinElmer Informatics
- 6.3.9 Certara
- 6.3.10 OpenEye Scientific
- 6.3.11 Acellera Ltd.
- 6.3.12 Biomax Informatics AG
- 6.3.13 Charles River Laboratories
- 6.3.14 Horiba Ltd.
- 6.3.15 CD BioSciences
- 6.3.16 Agile Molecule
- 6.3.17 BioSolveIT GmbH
- 6.3.18 Simulations Plus
- 6.3.19 Genedata AG
- 6.3.20 Q-Chem Inc.
7. 시장 기회 및 미래 전망
❖본 조사 보고서에 관한 문의는 여기로 연락주세요.❖
구조 생물학 및 분자 모델링 기술은 생명 현상의 근원적인 이해와 혁신적인 바이오 기술 개발에 필수적인 핵심 역량으로 자리매김하고 있습니다. 이 두 분야는 상호 보완적으로 작용하며, 생체 분자의 3차원 구조와 동역학적 특성을 규명하고 예측함으로써 생명 과학 연구 및 산업 전반에 걸쳐 지대한 영향을 미치고 있습니다.
정의
구조 생물학은 단백질, 핵산, 지질, 탄수화물 등 생체 고분자의 3차원 구조를 원자 수준에서 결정하고, 이 구조가 생물학적 기능과 어떻게 연관되는지를 연구하는 학문 분야입니다. 이는 생체 분자의 기능 발현 메커니즘을 이해하는 데 근간이 됩니다. 반면, 분자 모델링 기술은 컴퓨터 기반의 시뮬레이션 및 계산 방법을 활용하여 분자 시스템의 구조, 동역학, 상호작용 및 물리화학적 특성을 예측하고 분석하는 기술입니다. 이는 실험적 구조 결정의 한계를 보완하고, 새로운 가설을 생성하며, 실험 설계의 효율성을 높이는 데 기여합니다. 구조 생물학이 실제 분자 구조 데이터를 제공한다면, 분자 모델링은 이 데이터를 해석하고 확장하며, 예측을 통해 미래 연구 방향을 제시하는 역할을 수행합니다.
유형
구조 생물학 기술은 주로 실험적 방법을 통해 생체 분자의 구조를 결정합니다. 대표적으로 X선 결정학은 단백질 결정에 X선을 쬐어 얻은 회절 패턴을 분석하여 원자 수준의 고해상도 3차원 구조를 규명하는 가장 보편적인 방법입니다. 핵자기 공명(NMR) 분광법은 용액 상태의 단백질에 자기장을 가하여 원자핵의 스핀 변화를 측정함으로써 동역학적 정보와 함께 3차원 구조를 결정합니다. 최근 비약적인 발전을 이룬 극저온 전자 현미경(Cryo-EM)은 생체 분자 시료를 급속 냉각하여 전자빔으로 이미지를 얻고 3차원 재구성하여 거대 복합체나 막 단백질과 같은 난해한 구조를 고해상도로 분석하는 데 탁월한 성능을 보이고 있습니다.
분자 모델링 기술은 다양한 계산 방법론을 포함합니다. 분자 동역학(MD) 시뮬레이션은 뉴턴의 운동 방정식을 사용하여 원자들의 시간 경과에 따른 움직임을 시뮬레이션함으로써 분자 시스템의 동역학적 거동과 열역학적 특성을 연구합니다. 도킹 시뮬레이션은 리간드(약물 후보 물질)가 단백질 수용체에 결합하는 방식을 예측하여 결합 친화도와 결합 위치를 파악하며 신약 개발에 필수적으로 활용됩니다. 양자 화학 계산은 슈뢰딩거 방정식을 기반으로 전자의 거동을 정밀하게 계산하여 분자의 전자 구조, 반응 메커니즘, 스펙트럼 특성 등을 예측합니다. 상동성 모델링은 서열 유사성이 높은 알려진 단백질 구조를 주형으로 사용하여 미지의 단백질 3차원 구조를 예측하는 방법입니다. 최근에는 인공지능(AI) 및 머신러닝 기반 모델링, 특히 딥러닝을 활용한 AlphaFold와 같은 기술이 단백질 서열로부터 3차원 구조를 예측하는 데 혁신적인 정확도를 보여주며 약물 발견 및 최적화 분야에 새로운 지평을 열고 있습니다.
활용 분야
이 기술들은 신약 개발 분야에서 핵심적인 역할을 수행합니다. 질병 관련 표적 단백질의 구조를 규명하고 활성 부위를 분석하여 약물 후보 물질의 설계 및 최적화에 활용됩니다. 리간드-단백질 상호작용 예측을 통해 가상 스크리닝으로 선도 물질을 발굴하고, 약물 부작용 예측 및 약물 재창출에도 기여합니다. 생명 공학 및 효소 공학 분야에서는 효소의 반응 메커니즘을 이해하고 활성을 증진시키거나 새로운 기능의 단백질을 설계하는 데 활용됩니다. 또한, 질병 메커니즘 규명에 필수적이며, 바이러스 감염 메커니즘 연구 및 백신 개발에도 중요한 정보를 제공합니다. 나아가 재료 과학 분야에서는 고분자 재료의 구조-물성 관계 연구 및 나노 물질 설계에도 응용되고 있습니다.
관련 기술
구조 생물학 및 분자 모델링 기술의 발전은 다양한 관련 기술과의 융합을 통해 가속화되고 있습니다. 고성능 컴퓨팅(HPC)은 분자 동역학 시뮬레이션이나 양자 화학 계산과 같이 막대한 계산 자원을 요구하는 작업에 필수적이며, 슈퍼컴퓨터 및 GPU 클러스터의 발전이 이 분야의 성장을 견인합니다. 데이터 과학 및 인공지능은 방대한 구조 및 시뮬레이션 데이터를 분석하고, 새로운 모델링 알고리즘을 개발하며, 약물 후보 물질 예측의 정확도를 높이는 데 결정적인 역할을 합니다. 생물 정보학은 유전체 및 단백체 데이터를 분석하고 서열-구조-기능 관계를 예측하며, 구조 생물학 데이터베이스를 관리하는 데 필수적입니다. 합성 생물학은 생체 시스템을 설계하고 재구성하는 분야로서, 구조 생물학 및 분자 모델링은 설계된 생체 분자의 구조적 안정성과 기능성을 예측하는 데 기여합니다. 화학 정보학 또한 화학 물질의 구조, 특성, 활성 데이터를 관리하고 분석하여 약물 발견 및 재료 설계에 활용됩니다.
시장 배경
구조 생물학 및 분자 모델링 기술 시장은 신약 개발의 복잡성 증가, 정밀 의학의 부상, 바이오 의약품 시장 확대, 그리고 인공지능 기술의 접목이라는 강력한 성장 동력을 바탕으로 빠르게 성장하고 있습니다. 제약 및 바이오 기업, 계약 연구 기관(CRO), 전문 소프트웨어 개발사(예: Schrödinger, Dassault Systèmes BIOVIA), 그리고 학술 연구 기관들이 주요 플레이어로 활동하고 있습니다. 정부 및 민간 부문의 R&D 투자가 활발하며, 특히 AI 기반의 신약 개발 플랫폼에 대한 투자가 집중되고 있습니다. 클라우드 기반의 컴퓨팅 자원 활용 또한 증가하는 추세입니다. 그러나 높은 초기 투자 비용, 복잡한 기술 전문성 요구, 그리고 대규모 데이터 처리 및 분석의 어려움은 여전히 도전 과제로 남아 있습니다.
미래 전망
미래에는 인공지능 및 머신러닝과의 융합이 더욱 가속화될 것입니다. AlphaFold와 같은 혁신적인 AI 모델의 등장은 단백질 구조 예측의 정확도를 획기적으로 높였으며, 앞으로 약물-표적 상호작용 예측, 신규 물질 설계 등 다양한 분야로 확장될 것입니다. 또한, 원자 수준에서 세포, 조직 수준까지 다양한 스케일의 시뮬레이션을 통합하여 생체 시스템을 보다 포괄적으로 이해하려는 멀티스케일 모델링 연구가 강화될 것입니다. 실험적 구조 결정 기술(Cryo-EM, X선 결정학)과 분자 모델링 기술이 더욱 긴밀하게 통합되어, 상호 보완적인 방식으로 복잡한 생체 시스템을 연구하는 통합 실험-계산 연구가 주류를 이룰 것으로 예상됩니다. 정밀 의학 및 개인 맞춤형 치료 시대에는 환자 개개인의 유전체 및 단백체 정보를 기반으로 질병 관련 단백질의 구조적 특성을 분석하고, 맞춤형 약물을 설계하는 데 이 기술들이 핵심적인 역할을 할 것입니다. 나아가 생체 모방 재료, 촉매 개발 등 신소재 및 에너지 분야에서도 구조 생물학 및 분자 모델링 기술의 활용이 확대될 것으로 전망됩니다. 이러한 기술들은 생명 과학 연구의 패러다임을 전환하고 인류의 건강과 삶의 질 향상에 지속적으로 기여할 것입니다.