❖본 조사 보고서의 견적의뢰 / 샘플 / 구입 / 질문 폼❖
암 단일클론 항체 시장 규모 및 예측 보고서 2031 요약
시장 개요 및 예측
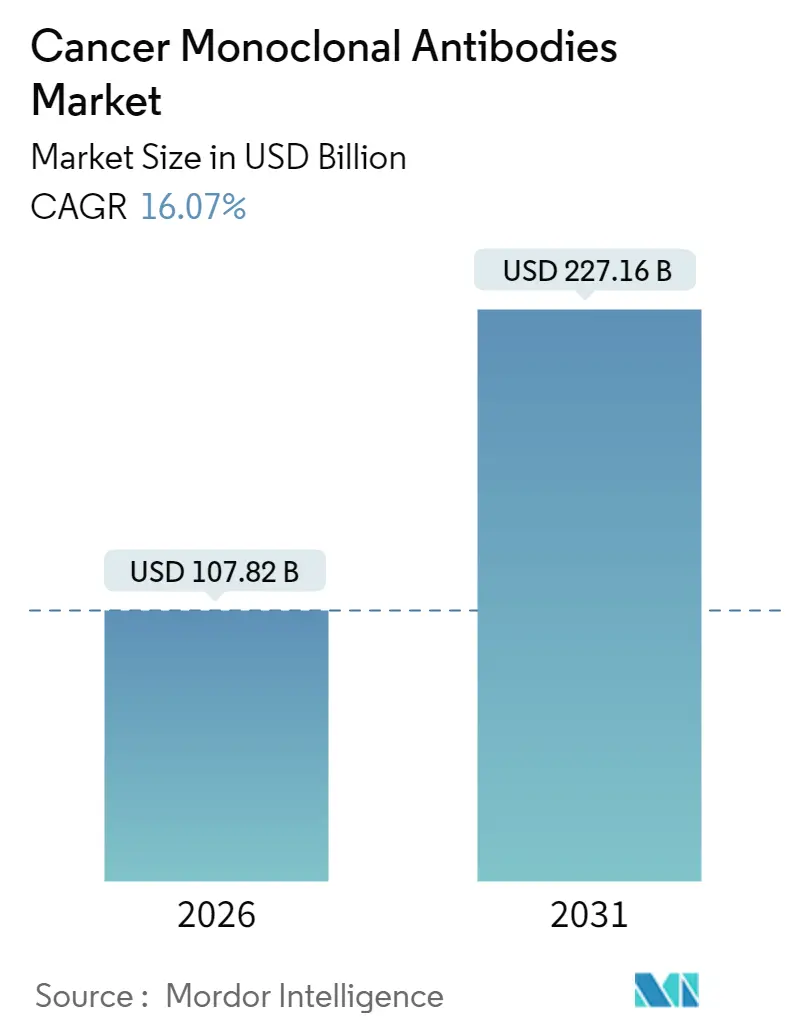
암 단일클론 항체(Cancer Monoclonal Antibodies) 시장은 2025년 928.9억 달러에서 2026년 1,078.2억 달러로 성장했으며, 2031년에는 2,271.6억 달러에 이를 것으로 전망됩니다. 2026년부터 2031년까지 연평균 성장률(CAGR)은 16.07%로 예측됩니다. 본 보고서는 2020년부터 2031년까지의 시장을 분석하며, 항체 공급원, 단일클론 항체 치료법, 암 적용 분야, 유통 채널 및 지역별로 시장을 세분화하여 가치(USD) 기준으로 예측을 제공합니다.
이 시장의 성장은 인공지능(AI) 기반 항체 설계, 이중특이성 항체(bispecific antibodies)의 신속한 규제 승인 경로, 항체-약물 접합체(ADCs)의 광범위한 채택에 힘입어 치료 범위가 확대되고 수익 가시성이 높아지는 데 기인합니다. 계약 제조업체의 생산 능력 확장, 가치 기반 종양학 치료로의 전환, 중국 바이오기술 기업의 획기적인 임상 데이터 또한 경쟁 역학을 재편하며 파이프라인 생산성을 높이고 있습니다.
주요 시장 통계 (2025년 기준)
* 시장 규모 (2026년): 1,078.2억 달러
* 시장 규모 (2031년): 2,271.6억 달러
* 성장률 (2026-2031): 16.07% CAGR
* 가장 빠르게 성장하는 시장: 아시아 태평양
* 가장 큰 시장: 북미
* 시장 집중도: 중간
주요 보고서 요약
* 항체 공급원별: 2025년 휴먼화 항체가 암 단일클론 항체 시장 점유율의 50.62%를 차지했으며, 완전 인간 항체는 2031년까지 18.59%의 CAGR로 가장 빠르게 성장할 것으로 예상됩니다.
* 치료법별: 2025년 트라스투주맙(Trastuzumab)이 암 단일클론 항체 시장 규모의 16.72%를 차지했으며, ‘기타’ 범주는 2026-2031년 동안 20.61%의 CAGR로 성장할 것으로 전망됩니다.
* 암 적용 분야별: 2025년 유방암이 암 단일클론 항체 시장 규모의 25.12%를 차지했으며, 간암 및 위장관암은 2031년까지 16.41%의 CAGR로 성장할 것으로 예측됩니다.
* 유통 채널별: 2025년 병원 약국이 매출의 52.24%를 차지했으며, 온라인 약국은 2031년까지 17.95%의 CAGR로 가장 높은 성장률을 기록할 것으로 보입니다.
* 지역별: 2025년 북미가 암 단일클론 항체 시장 점유율의 41.78%를 유지했으며, 아시아 태평양은 2031년까지 18.92%의 CAGR로 가장 빠르게 확장될 것으로 예상됩니다.
시장 동향 및 통찰력
시장 성장 동인
암 단일클론 항체 시장의 성장을 견인하는 주요 요인들은 다음과 같습니다.
* 전 세계 암 발병률 증가: 2022년 2천만 건에서 2050년 3천5백만 건으로 77% 증가할 것으로 예상되는 암 발병률은 폐암, 유방암, 대장암 등 다양한 암종에서 환자 풀을 확대하고 있습니다. 고령화 사회와 신흥 경제국의 생활 습관 변화는 표적 생물학적 제제에 대한 수요를 증폭시키며, 단일클론 항체가 정밀 종양학 프로토콜에 부합하는 종양 특이적 작용을 제공함에 따라 시장 성장에 기여하고 있습니다. (CAGR 영향 +3.2%, 장기적, 전 세계적)
* 종양학 R&D 투자 확대: 종양학은 생물제약 R&D 예산에서 가장 큰 비중을 차지하며, 종양학 임상 시험의 35%가 항체-약물 접합체 또는 다중특이성 구조를 포함하고 있습니다. 개발 생산성 향상과 블록버스터급 인수합병(예: Bristol Myers Squibb의 Mirati 인수, Eli Lilly의 Point Biopharma 인수)은 후기 단계 파이프라인을 강화하고 있습니다. (CAGR 영향 +2.8%, 중기적, 북미 및 EU)
* 휴먼화 및 완전 인간 항체의 임상적 성공 입증: 2024년 규제 당국은 25개의 새로운 종양학 생물학적 제제를 승인했으며, 이들 중 다수는 면역원성을 낮춘 휴먼화 또는 완전 인간 항체 형태를 기반으로 합니다. 피하 투여 제형은 투여 시간을 단축하여 환자 순응도를 높이고 주입 용량을 확보합니다. (CAGR 영향 +2.1%, 단기적, 전 세계적)
* 이중특이성 항체 및 항체-약물 접합체(ADCs)의 등장: 2023년 말까지 14개의 이중특이성 항체가 전 세계적으로 승인되었으며, 시판 중인 ADCs와 함께 2028년까지 260억 달러 이상의 매출을 기록할 것으로 예상됩니다. 복잡한 제조 공정은 진입 장벽을 높여 혁신 기업을 보호하는 동시에 계약 제조 수요를 촉진합니다. (CAGR 영향 +4.3%, 중기적, 전 세계적, 중국이 임상 주도)
* AI 기반 항체 공학 채택: AI 기반 항체 공학의 도입은 항체 설계 및 개발 과정을 가속화하여 치료제 개발의 효율성을 높이고 있습니다. (CAGR 영향 +1.9%, 장기적, 북미 및 EU, 아시아 태평양 확장 중)
* 가치 기반 종양학 모델로의 전환: 가치 기반 의료 모델로의 전환은 비용 효율적이고 효과적인 치료법에 대한 수요를 증가시키며, 이는 단일클론 항체 시장에 긍정적인 영향을 미칩니다. (CAGR 영향 +1.3%, 중기적, 북미 및 EU)
시장 제약 요인
암 단일클론 항체 시장의 성장을 저해하는 주요 요인들은 다음과 같습니다.
* 엄격한 규제 및 안전성 모니터링: 규제 기관은 이중특이성 항체 및 ADCs에 대한 통합 안전성 데이터를 요구하며, 소아 연구 규정 및 비교 효과 검토를 추가하여 개발 기간과 비용을 증가시킵니다. (CAGR 영향 -2.1%, 단기적, 전 세계적, 선진 시장에서 가장 강함)
* 높은 임상 실패율 및 긴 개발 주기: 신약 개발의 본질적인 특성상 높은 임상 실패율과 긴 개발 주기는 특히 소규모 기업에 큰 부담으로 작용합니다. (CAGR 영향 -1.8%, 장기적, 전 세계적)
* 생물반응기 및 원자재 공급의 병목 현상: 2024년 전 세계 생물반응기 용량은 1,740만 리터에 달했지만, 수요 증가가 여전히 공급 능력을 초과하고 있습니다. 세포 배양 배지 및 일회용 백의 부족은 리드 타임 인플레이션을 유발하며, 이는 계약 제조 비용을 상승시키고 제품 출시를 지연시킬 수 있습니다. (CAGR 영향 -2.3%, 중기적, 전 세계적, 아시아 태평양 구축에 심각)
* 첨단 치료법과의 경쟁 심화: CAR-T 및 유전자 편집 치료법과 같은 첨단 치료법의 등장은 단일클론 항체 시장에 경쟁 압력을 가하고 있습니다. (CAGR 영향 -1.4%, 장기적, 북미 및 EU, 전 세계로 확대)
세그먼트 분석
* 항체 공급원별: 휴먼화 항체는 2025년 매출의 50.62%를 차지하며 시장을 주도했습니다. 그러나 완전 인간 항체는 우수한 안전성과 병용 요법에서의 사용 증가에 힘입어 2031년까지 18.59%의 CAGR로 가장 빠르게 성장할 것으로 예상됩니다. 제조 공정의 단순성과 유리한 규제 프로파일은 완전 인간 항체가 예측 기간 동안 틈새시장에서 주류로 이동할 수 있는 기반을 마련하고 있습니다.
* 단일클론 항체 치료법별: 트라스투주맙은 HER2 양성 유방암 분야에서의 깊은 의사 친숙도와 강력한 증거를 바탕으로 2025년 시장 점유율의 16.72%를 차지했습니다. 그러나 ADCs 및 이중특이성 항체를 중심으로 한 혁신 물결은 ‘기타’ 범주를 연간 20.61% 성장시키고 있습니다. 새로운 승인(예: HER2-low 질환용 트라스투주맙 데룩스테칸)은 더 넓은 환자군에게 혜택을 제공합니다.
* 암 적용 분야별: 유방암은 HER2 표적 요법의 확고한 입지와 호르몬 수용체 양성 환경에서의 채택 증가로 2025년 시장 규모의 25.12%를 차지했습니다. 간암 및 위장관암은 TROP2 및 EGFR 변이와 같은 신흥 표적이 후기 단계 임상 시험으로 진입함에 따라 2031년까지 16.41%의 CAGR로 성장할 것으로 예상됩니다.
* 유통 채널별: 병원 약국은 많은 단일클론 항체가 여전히 감독 하에 주입되어야 하므로 2025년 전 세계 매출의 52.24%를 차지했습니다. 그러나 피하 주사 제형은 환자들이 자가 투여를 수용함에 따라 온라인 약국 매출을 17.95%의 CAGR로 촉진하고 있습니다.
지역 분석
* 북미: 2025년 전 세계 매출의 41.78%를 차지하며 선두를 유지하고 있습니다. 이는 강력한 임상 시험 생태계와 우호적인 보험 정책에 힘입은 결과입니다. 피하 주사 펨브롤리주맙(pembrolizumab) 승인은 환자 중심 투여를 위한 지역의 노력을 보여줍니다.
* 아시아 태평양: 2031년까지 18.92%의 CAGR로 가장 빠르게 성장할 것으로 예상됩니다. 이는 종양학 예산 증가, 인구 고령화, 규제 기관의 신속 승인 경로 지원을 반영합니다. 중국의 Akeso가 Keytruda보다 우수한 결과를 보인 이보네시맙(ivonescimab)을 개발하는 등 국내 항체 플랫폼에 대한 신뢰와 투자를 유치하고 있습니다.
* 유럽: 승인 절차를 간소화하면서도 예산을 관리하는 공동 임상 평가를 통해 균형 잡힌 접근 방식을 추구합니다. 린보셀타맙(linvoseltamab)과 같은 획기적인 항체에 대한 조건부 판매 허가는 높은 미충족 수요를 해결하는 데 있어 민첩성을 보여줍니다.
* 중동 및 아프리카, 남미: 정부가 보편적 의료 보장 계획에서 종양학을 우선순위에 두면서 점진적인 성장을 보이고 있습니다. 외국인 직접 투자는 수입 주기를 단축하는 완제 의약품 생산 공장으로 유입되고 있습니다.
경쟁 환경 및 주요 기업
암 단일클론 항체 시장은 중간 정도의 집중도를 보입니다. 서구의 주요 기업들이 여전히 큰 포트폴리오를 보유하고 있지만, 아시아 바이오기술 기업들은 경쟁력 있는 임상 데이터와 낮은 개발 비용으로 시장을 교란하고 있습니다. 계약 제조의 확산과 높은 신약 발견 복잡성은 진입 장벽을 형성하여 시장 분열 압력을 부분적으로 상쇄합니다.
전략적 M&A 및 라이선싱 계약이 성장을 주도하고 있습니다. 예를 들어, Pfizer는 3SBio와 PD-1/VEGF 이중특이성 항체에 대한 12.5억 달러 규모의 글로벌 계약을 체결했으며, BioNTech와 Bristol Myers Squibb는 BNT327 공동 개발을 위해 15억 달러를 선지급했습니다. 주요 기업들은 AI 도구를 통합하고, 연속 생물공정에 투자하며, 환자 지원 생태계를 구축하여 순응도를 개선하고 서비스 품질을 차별화하고 있습니다.
주요 시장 참여 기업으로는 Amgen Inc., Eli Lilly and Company, F. Hoffmann-La Roche Ltd (Genentech Inc), Merck & Co., Inc., Novartis AG 등이 있습니다.
최근 산업 동향
* 2025년 6월: BioNTech와 Bristol Myers Squibb는 PD-L1 및 VEGF-A를 표적하는 이중특이성 항체 BNT327의 공동 개발을 위한 글로벌 전략적 파트너십을 발표했습니다. 선지급금 15억 달러와 잠재적 마일스톤 지급액 총 76억 달러 규모입니다.
* 2025년 6월: Roche는 Tecentriq와 lurbinectedin 병용 요법이 광범위 소세포 폐암 환자의 생존율을 유의미하게 개선했음을 보여주는 긍정적인 임상 3상 IMforte 연구 결과를 보고했습니다.
* 2025년 5월: Pfizer는 3SBio와 PD-1 및 VEGF를 표적하는 이중특이성 항체 SSGJ-707에 대한 독점 글로벌 라이선싱 계약을 체결했습니다. 선지급금 12.5억 달러와 잠재적 마일스톤 지급액 최대 48억 달러 규모입니다.
* 2025년 4월: FDA는 비각질화 비인두암 치료제 penpulimab-kcqx를 승인했습니다. 이 병용 요법은 9.6개월의 중앙 무진행 생존 기간을 보였으며, 신속 심사, 혁신 치료제, 희귀 의약품 지정을 받았습니다.
본 보고서는 암 단일클론항체(mAbs) 시장에 대한 포괄적인 분석을 제공합니다. 이 시장은 고형암 또는 혈액암의 진단 및 치료를 위해 규제 기관의 승인을 받은 모든 처방 등급 항체 분자를 포함하며, 공장 출하 가격 기준으로 병원, 소매 및 온라인 약국 채널을 통한 매출을 평가합니다. 빈혈, 호중구 감소증 또는 자가면역 질환에만 사용되는 보조 생물학적 제제는 분석 범위에서 제외됩니다.
보고서에 따르면, 암 단일클론항체 시장은 2026년 1,078억 2천만 달러 규모에서 2031년까지 2,271억 6천만 달러로 성장할 것으로 예상되며, 연평균 성장률(CAGR)은 16.07%에 달합니다. 특히 아시아-태평양 지역은 중국의 대규모 임상시험 파이프라인과 제조 역량 확장에 힘입어 18.92%의 가장 높은 CAGR을 기록하며 빠르게 성장할 것으로 전망됩니다.
시장 성장의 주요 동력으로는 전 세계적인 암 발병률 증가, 항암 R&D 투자 확대, 인간화 및 완전 인간 항체의 임상적 성공 입증, 이중특이성 항체(Bispecific Antibodies) 및 항체-약물 접합체(ADCs)의 등장, AI 기반 항체 공학 기술 도입, 그리고 가치 기반 항암 치료 모델로의 전환 등이 있습니다. 반면, 엄격한 규제 및 안전성 모니터링, 높은 임상 실패율과 긴 개발 주기, 생물반응기 및 원자재 공급의 병목 현상, CAR-T 및 유전자 편집 치료제와 같은 첨단 치료법과의 경쟁 심화는 시장 성장을 저해하는 요인으로 작용할 수 있습니다.
시장은 다양한 기준으로 세분화되어 분석됩니다.
* 항체 공급원별: 마우스 유래(Murine), 키메라(Chimeric), 인간화(Humanized), 완전 인간(Fully-Human) 항체로 나뉘며, 인간화 항체가 50.62%의 매출 점유율로 선두를 유지하고 있습니다. 면역원성이 낮고 병용 요법에 폭넓게 활용될 수 있는 완전 인간 항체가 18.59%의 CAGR로 가장 빠르게 성장하고 있습니다.
* 단일클론항체 치료제별: 베바시주맙(Bevacizumab), 트라스투주맙(Trastuzumab), 리툭시맙(Rituximab), 세툭시맙(Cetuximab), 다라투무맙(Daratumumab) 등 주요 치료제와 기타 제품군을 다룹니다.
* 암 적용 분야별: 유방암, 혈액암, 대장암, 폐암, 간 및 위장관암, 기타 고형암 등 다양한 암종에 대한 적용을 분석합니다.
* 유통 채널별: 병원 약국이 52.24%의 점유율로 여전히 지배적이지만, 피하 주사 제형의 등장으로 자가 투여가 가능해지면서 온라인 약국이 17.95%의 CAGR로 빠르게 성장하고 있습니다. 소매 약국도 포함됩니다.
* 지역별: 북미(미국, 캐나다, 멕시코), 유럽(독일, 영국, 프랑스, 이탈리아, 스페인 등), 아시아-태평양(중국, 일본, 인도, 호주, 한국 등), 중동 및 아프리카, 남미 등 주요 지역 및 국가별 시장을 상세히 분석합니다.
경쟁 환경 분석에서는 시장 집중도와 주요 기업들의 시장 점유율을 다루며, F. Hoffmann-La Roche Ltd, Merck & Co., Inc., Bristol Myers Squibb Co., Amgen Inc., Novartis AG, Johnson & Johnson, AstraZeneca, Eli Lilly and Company, Pfizer Inc., GlaxoSmithKline PLC, Regeneron Pharmaceuticals, AbbVie Inc., Seagen Inc., Daiichi Sankyo Co. Ltd, Sanofi SA, Genmab A/S, BeiGene Ltd, Spectrum Pharmaceuticals Inc., Mitsubishi Tanabe Pharma, WuXi Biologics 등 20개 주요 기업의 프로필을 제공합니다.
본 보고서는 WHO GLOBOCAN, CDC SEER, OECD Health Stats 등의 공개 데이터셋을 활용한 데스크 리서치와 종양 전문의, 병원 약사, 지불자, 지역 유통업체와의 구조화된 인터뷰를 통한 1차 조사를 결합한 하향식 및 상향식 모델을 기반으로 시장을 분석하고 예측합니다. 데이터는 매년 업데이트되며, 주요 승인, 가격 조정, 상환 정책 변화 시 중간 업데이트가 이루어집니다.
결론적으로, 암 단일클론항체 시장은 높은 성장 잠재력을 가지고 있으며, 혁신적인 치료법 개발과 AI 기술의 접목을 통해 미래 전망이 밝습니다. 그러나 규제 및 제조상의 도전 과제들을 극복하는 것이 중요합니다.

1. 서론
- 1.1 연구 가정 & 시장 정의
- 1.2 연구 범위
2. 연구 방법론
3. 요약
4. 시장 환경
- 4.1 시장 개요
- 4.2 시장 동인
- 4.2.1 전 세계 암 발병률 증가
- 4.2.2 종양학 R&D 투자 증가
- 4.2.3 인간화 및 완전 인간 단일클론항체의 입증된 임상 성공
- 4.2.4 이중특이성 항체 및 항체-약물 접합체(ADC)의 출현
- 4.2.5 AI 기반 항체 공학 채택
- 4.2.6 가치 기반 종양학 치료 모델로의 전환
- 4.3 시장 제약
- 4.3.1 엄격한 규제 및 안전 모니터링
- 4.3.2 높은 임상 중단율 및 긴 개발 주기
- 4.3.3 생물반응기 및 원료 공급의 제조 병목 현상
- 4.3.4 첨단 치료법과의 경쟁 심화
- 4.4 규제 환경
- 4.5 포터의 5가지 경쟁 요인 분석
- 4.5.1 신규 진입자의 위협
- 4.5.2 구매자의 교섭력
- 4.5.3 공급자의 교섭력
- 4.5.4 대체재의 위협
- 4.5.5 경쟁 강도
5. 시장 규모 및 성장 예측 (USD 가치)
- 5.1 항체 공급원별
- 5.1.1 쥐 유래
- 5.1.2 키메라
- 5.1.3 인간화
- 5.1.4 완전 인간
- 5.2 단일클론 항체 치료법별
- 5.2.1 베바시주맙
- 5.2.2 트라스투주맙
- 5.2.3 리툭시맙
- 5.2.4 세툭시맙
- 5.2.5 다라투무맙
- 5.2.6 기타
- 5.3 암 적용 분야별
- 5.3.1 유방암
- 5.3.2 혈액암
- 5.3.3 대장암
- 5.3.4 폐암
- 5.3.5 간 & 위장암
- 5.3.6 기타 고형 종양
- 5.4 유통 채널별
- 5.4.1 병원 약국
- 5.4.2 소매 약국
- 5.4.3 온라인 약국
- 5.5 지역별
- 5.5.1 북미
- 5.5.1.1 미국
- 5.5.1.2 캐나다
- 5.5.1.3 멕시코
- 5.5.2 유럽
- 5.5.2.1 독일
- 5.5.2.2 영국
- 5.5.2.3 프랑스
- 5.5.2.4 이탈리아
- 5.5.2.5 스페인
- 5.5.2.6 유럽 기타 지역
- 5.5.3 아시아 태평양
- 5.5.3.1 중국
- 5.5.3.2 일본
- 5.5.3.3 인도
- 5.5.3.4 호주
- 5.5.3.5 대한민국
- 5.5.3.6 아시아 태평양 기타 지역
- 5.5.4 중동 & 아프리카
- 5.5.4.1 GCC
- 5.5.4.2 남아프리카
- 5.5.4.3 중동 & 아프리카 기타 지역
- 5.5.5 남미
- 5.5.5.1 브라질
- 5.5.5.2 아르헨티나
- 5.5.5.3 남미 기타 지역
6. 경쟁 환경
- 6.1 시장 집중도
- 6.2 시장 점유율 분석
- 6.3 기업 프로필 (글로벌 개요, 시장 개요, 핵심 부문, 재무 정보(사용 가능한 경우), 전략 정보, 주요 기업의 시장 순위/점유율, 제품 & 서비스, 최근 개발 포함)
- 6.3.1 F. Hoffmann-La Roche Ltd
- 6.3.2 Merck & Co., Inc.
- 6.3.3 Bristol Myers Squibb Co.
- 6.3.4 Amgen Inc.
- 6.3.5 Novartis AG
- 6.3.6 Johnson & Johnson
- 6.3.7 AstraZeneca
- 6.3.8 Eli Lilly and Company
- 6.3.9 Pfizer Inc.
- 6.3.10 GlaxoSmithKline PLC
- 6.3.11 Regeneron Pharmaceuticals
- 6.3.12 AbbVie Inc.
- 6.3.13 Seagen Inc.
- 6.3.14 Daiichi Sankyo Co. Ltd
- 6.3.15 Sanofi SA
- 6.3.16 Genmab A/S
- 6.3.17 BeiGene Ltd
- 6.3.18 Spectrum Pharmaceuticals Inc.
- 6.3.19 Mitsubishi Tanabe Pharma
- 6.3.20 WuXi Biologics
7. 시장 기회 & 미래 전망
❖본 조사 보고서에 관한 문의는 여기로 연락주세요.❖
암 단일클론 항체는 특정 암세포 표면에 발현되는 항원에만 선택적으로 결합하도록 인공적으로 생산된 항체입니다. 이는 우리 몸의 면역 체계가 비정상 세포를 인식하고 제거하는 항체의 원리를 모방한 생물학적 제제입니다. 단일클론 항체는 하나의 특정 항원에만 반응하는 동일한 항체 분자들의 집합으로, 정상 세포 손상을 최소화하며 암세포만을 정밀하게 표적 공격합니다. 이러한 특이성은 기존 화학 요법이나 방사선 요법의 비특이적 독성 문제를 극복하고, 암 치료의 효율성과 안전성을 크게 향상시키는 핵심 요소입니다.
암 단일클론 항체는 작용 기전에 따라 다양하게 분류됩니다. 직접 작용 항체는 암세포 성장, 분화, 생존에 필수적인 수용체(예: EGFR, HER2)에 결합하여 신호 전달을 차단하거나, 면역 세포에 의한 암세포 사멸(ADCC, CDC)을 유도합니다. 혈관 신생 억제 항체(예: VEGF 표적)도 여기에 포함됩니다. 면역 관문 억제제는 암세포가 면역 회피에 사용하는 단백질(예: PD-1, PD-L1, CTLA-4)을 차단하여, 억제된 면역 세포의 활성을 되살려 암세포를 공격하게 합니다.